Chloratomer i hydrogenchlorid har en stærkere tiltrækning for elektronerne end molekyle er derfor ikke -polært kovalent molekyle?
Hvad er sandt:
* Elektronegativitet: Chlor (CL) er mere elektronegativ end brint (H). Dette betyder, at klor har et stærkere træk på delte elektroner i en binding.
* polær kovalent binding: Forskellen i elektronegativitet mellem klor og brint skaber en polær kovalent binding . Chloratomet vil have en lidt negativ ladning (Δ-), mens brintatomet vil have en lidt positiv ladning (Δ+).
Hvad er forkert:
* ikke -polært kovalent molekyle: Erklæringen konkluderer forkert, at hydrogenchlorid (HCI) er ikke -polær. På grund af den polære kovalente binding er HCL et polært molekyle.
Hvorfor HCL er polær:
Den ujævne deling af elektroner skaber et permanent dipolmoment i HCL -molekylet. Klorenden er mere negativ, og brintenden er mere positiv. Denne adskillelse af ladning gør molekylet polær.
Kortfattet:
* HCL er et polært molekyle på grund af den polære kovalente binding mellem brint og klor. Chloratomets stærkere træk på delte elektroner skaber en delvis negativ ladning på klorenden.
Sidste artikelHvilken forbindelse er ALCL?
Næste artikelHvilken ionisk forbindelse dannes, når brint og chlor kombineres?
 Varme artikler
Varme artikler
-
 Leviathan polymer børste lavet med E. coli holder bakterier i skakMikroskopisk monster:Et tilfældigt øjeblik i laboratoriet førte til skabelsen af polymerbørster 100 gange den sædvanlige størrelse. Børsterne er synlige under mikroskopet, hvorimod polymerbørster no
Leviathan polymer børste lavet med E. coli holder bakterier i skakMikroskopisk monster:Et tilfældigt øjeblik i laboratoriet førte til skabelsen af polymerbørster 100 gange den sædvanlige størrelse. Børsterne er synlige under mikroskopet, hvorimod polymerbørster no -
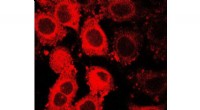 GLUT5 fluorescerende sonde fingeraftryk kræftcellerManCou flerfarvede fluorescerende sonde lyser i forskellige farver og forskellige intensiteter afhængigt af en kræftcelles type og malignitet. Kredit:Tanasova, Rao/Michigan Tech Bestemmelse af til
GLUT5 fluorescerende sonde fingeraftryk kræftcellerManCou flerfarvede fluorescerende sonde lyser i forskellige farver og forskellige intensiteter afhængigt af en kræftcelles type og malignitet. Kredit:Tanasova, Rao/Michigan Tech Bestemmelse af til -
 Naturligt silica-baseret pesticid beskytter afgrøder i opbevaring og kan fjerne giftig fosfinKredit:petrmalinak, Shutterstock Majs, hvede og ris udgør 90 procent af kornproduktionen globalt, og omkring 40 procent af alle kalorier i forbrugt mad. Men op til halvdelen af de høstede korn,
Naturligt silica-baseret pesticid beskytter afgrøder i opbevaring og kan fjerne giftig fosfinKredit:petrmalinak, Shutterstock Majs, hvede og ris udgør 90 procent af kornproduktionen globalt, og omkring 40 procent af alle kalorier i forbrugt mad. Men op til halvdelen af de høstede korn, -
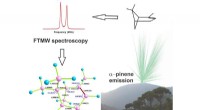 Molekylstrukturen i en skovaroma dekonstrueretGasfasestruktur af alfa-pinen er blevet eksperimentelt afsløret, ved hjælp af Fourier transform mikrobølgespektroskopi og kvantekemiske beregninger. Kredit:Elias M. Neeman Det friske, en umiskende
Molekylstrukturen i en skovaroma dekonstrueretGasfasestruktur af alfa-pinen er blevet eksperimentelt afsløret, ved hjælp af Fourier transform mikrobølgespektroskopi og kvantekemiske beregninger. Kredit:Elias M. Neeman Det friske, en umiskende


