Hvordan forklarer Octet -reglen dannelse af en chloridion?
Octet -reglen
Octet -reglen siger, at atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration af otte elektroner i deres yderste energiniveau (Valence Shell). Denne konfiguration ligner den af en ædel gas, der er kendt for deres stabilitet.
Chlorens elektronkonfiguration
* Chlor (CL) har 17 elektroner med en elektronisk konfiguration af 2, 8, 7. Dette betyder, at det har 7 elektroner i sin yderste skal.
* For at opnå en stabil octet har den brug for endnu en elektron.
Dannelse af chloridion
* Klor opnår en stabil oktet ved at få en elektron fra et andet atom.
* Denne forstærkning af en elektron resulterer i en negativ ladning på chloratomet og omdanner det til en chloridion (CL⁻).
* Chloridionen har nu 18 elektroner (2, 8, 8), hvilket giver det en fuld oktet og ligner elektronkonfigurationen af Argon (AR), en ædelgas.
Kortfattet: Octet -reglen forklarer dannelsen af chloridionen ved at indikere chlorens tendens til at få et elektron for at opnå en stabil konfiguration med otte elektroner i dets yderste skal. Denne elektronforstærkning fører til en negativ ladning og danner chloridion.
 Varme artikler
Varme artikler
-
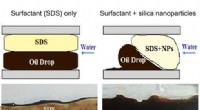 Nye materialer med vigtige anvendelser i forbedret oliegenvindingForskelle i bevægelsen af olie gennem mikrokanalerne ved tilsætning af overfladeaktivt stof i nærvær af silicananopartikler sammenlignet med det overfladeaktive middel alene, hvilket viser, hvordan
Nye materialer med vigtige anvendelser i forbedret oliegenvindingForskelle i bevægelsen af olie gennem mikrokanalerne ved tilsætning af overfladeaktivt stof i nærvær af silicananopartikler sammenlignet med det overfladeaktive middel alene, hvilket viser, hvordan -
 Lys afslapper krystal for at øge solcelleeffektivitetenKonstant belysning blev fundet for at slappe af gitteret af et perovskitlignende materiale, gør det mere effektivt til at opsamle sollys og omdanne det til energi. Det stabile materiale blev testet ti
Lys afslapper krystal for at øge solcelleeffektivitetenKonstant belysning blev fundet for at slappe af gitteret af et perovskitlignende materiale, gør det mere effektivt til at opsamle sollys og omdanne det til energi. Det stabile materiale blev testet ti -
 Brug nær-infrarødt lys til 3D-print et øre inde i kroppenIkke -invasiv in vivo 3D bioprinting auricle in situ. Kredit:Professor Maling Gou, State Key Laboratory of Biotherapy and Cancer Center, West China Hospital, Sichuan universitet. Et team af forske
Brug nær-infrarødt lys til 3D-print et øre inde i kroppenIkke -invasiv in vivo 3D bioprinting auricle in situ. Kredit:Professor Maling Gou, State Key Laboratory of Biotherapy and Cancer Center, West China Hospital, Sichuan universitet. Et team af forske -
 Forskere udvikler en metode til at undersøge millioner af potentielle egenproducerede lægemiddelka…Med en stor samling af fiskekroge, ETH-kemikere forsøger at fange fisken på en meget specifik måde, dvs. et molekylært mål. Kredit:ETH Zürich / Morris Köchle At lede efter nye stoffer er som at fi
Forskere udvikler en metode til at undersøge millioner af potentielle egenproducerede lægemiddelka…Med en stor samling af fiskekroge, ETH-kemikere forsøger at fange fisken på en meget specifik måde, dvs. et molekylært mål. Kredit:ETH Zürich / Morris Köchle At lede efter nye stoffer er som at fi
- Ny katalysator muliggør energivenlig ammoniakproduktion til gødning og alternativt brændstof
- Hvordan Einsteins ækvivalensprincip strækker sig til kvanteverdenen
- Hubble fanger tæt kuglehob NGC 1841
- Brug af droner til at vurdere afgrødeskader fra vildsvin
- Studiet hjælper med at forstå usynlige, men mægtige partikler
- Metamaterialeabsorbere til infrarøde inspektionsteknologier


