Helium og neon kan ikke danne forbindelser med fluor Hvorfor?
Her er hvorfor:
* stabile elektronkonfigurationer: Ædle gasser har en fuld ydre skal af elektroner, hvilket gør dem utroligt stabile og ureaktive. Helium har en fuld 1s orbital, mens Neon har hele 2'erne og 2p orbital.
* Høj ioniseringsenergier: De kræver en betydelig mængde energi for at fjerne en elektron, hvilket gør det meget vanskeligt at danne positive ioner.
* lave elektronaffiniteter: De har meget lille tendens til at få et elektron, hvilket gør det usandsynligt at danne negative ioner.
Derfor kan selv stærkt reaktive elementer som fluor ikke overvinde stabiliteten og inertiteten af helium og neon for at danne kemiske bindinger.
Kortfattet:
* helium og neon er ædle gasser, hvilket betyder, at de har en fuld ydre skal af elektroner, hvilket gør dem meget stabile.
* Denne stabilitet forhindrer dem i let at deltage i kemiske reaktioner, herunder med fluor.
Sidste artikelEr et overgangselement blødt metal?
Næste artikelReagerer syrer med metaller for at danne vand?
 Varme artikler
Varme artikler
-
 At belyse, hvordan asymmetri giver kemiske egenskaberKredit:CC0 Public Domain Du har hørt udtrykket form følger funktion? I materialevidenskab, funktion følger form. Ny forskning af Carnegies Olivier Gagné og samarbejdspartner Frank Hawthorne fra U
At belyse, hvordan asymmetri giver kemiske egenskaberKredit:CC0 Public Domain Du har hørt udtrykket form følger funktion? I materialevidenskab, funktion følger form. Ny forskning af Carnegies Olivier Gagné og samarbejdspartner Frank Hawthorne fra U -
 Elektricitetsdrevne undersøiske reaktioner kan have været vigtige for livets opståenForskningsgruppen har foreslået en effektiv mekanisme til at udnytte den kemiske energi, der genereres af varme hydrotermiske væsker, der strømmer ud af hydrotermiske ventilationsåbninger på Jordens t
Elektricitetsdrevne undersøiske reaktioner kan have været vigtige for livets opståenForskningsgruppen har foreslået en effektiv mekanisme til at udnytte den kemiske energi, der genereres af varme hydrotermiske væsker, der strømmer ud af hydrotermiske ventilationsåbninger på Jordens t -
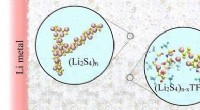 Optimering af lithium-svovl batterielektrolytter for lang levetidGenopladelige lithium-svovl batterier, hvor elektroderne er lavet af lithium (Li) metal og svovl (S) adskilt af en flydende elektrolyt, kunne erstatte lithium-ion-batterier, hvis vi kunne forstå, hvor
Optimering af lithium-svovl batterielektrolytter for lang levetidGenopladelige lithium-svovl batterier, hvor elektroderne er lavet af lithium (Li) metal og svovl (S) adskilt af en flydende elektrolyt, kunne erstatte lithium-ion-batterier, hvis vi kunne forstå, hvor -
 Samarbejde sætter gang i en ny model for keramisk ledningsevneKredit:CC0 Public Domain Som isolatorer, metaloxider - også kendt som keramik - virker måske ikke som oplagte kandidater til elektrisk ledningsevne. Mens elektroner lyner frem og tilbage i alminde
Samarbejde sætter gang i en ny model for keramisk ledningsevneKredit:CC0 Public Domain Som isolatorer, metaloxider - også kendt som keramik - virker måske ikke som oplagte kandidater til elektrisk ledningsevne. Mens elektroner lyner frem og tilbage i alminde
- Hvad vil der ske, hvis du bruger en 12V DC -adapter på 6V -produkt?
- Der er kun så langt, jeg kan tage dem:Hvorfor lærere giver op med at kæmpe elever, der ikke laver…
- Hvad er et stort højt stenet landområde, der kommer ud af overfladen?
- Uendelige muligheder for bio-nanoteknologi
- Hvad fik andelen af ilt i atmosfæren til at stige?
- Drivhusgasser og aerosoludledninger forlænger og forstærker tørken


