Hvad er afbalancering af en kemisk ligning, så det samme antal atomer, hvert element, der findes i både reaktanter og produkter, er et eksempel på hvad?
Her er et eksempel:
Ubalanceret ligning:
CH4 + O2 → CO2 + H2O
Forklaring:
* Reaktanter:metan (CH4) og ilt (O2)
* Produkter:Kuldioxid (CO2) og vand (H2O)
afbalanceret ligning:
CH4 + 2O2 → CO2 + 2H2O
Forklaring af afbalancering:
* carbon (c): Der er et carbonatom på hver side af ligningen (allerede afbalanceret).
* brint (H): Der er fire hydrogenatomer på reaktantsiden og to på produktsiden. For at afbalancere dette placerer vi en koefficient på 2 foran H2O.
* ilt (O): Der er to iltatomer på reaktantsiden og fire på produktsiden. For at afbalancere dette placerer vi en koefficient på 2 foran O2.
Hvorfor afbalancering er vigtig:
* bevarelse af masse: Afbalancering sikrer, at det samme antal atomer i hvert element er til stede før og efter reaktionen, der tilfredsstiller loven om bevarelse af masse.
* Forudsigelse af reaktionsstøkiometri: Afbalancerede ligninger tilvejebringer molforholdene mellem reaktanter og produkter, hvilket giver os mulighed for at forudsige de nødvendige mængder af de nødvendige reaktanter eller produkter, der er dannet i en reaktion.
* nøjagtig repræsentation af kemiske reaktioner: Afbalancerede ligninger skildrer nøjagtigt de kemiske transformationer, der forekommer i en reaktion, hvilket giver en klar og nøjagtig repræsentation af processen.
Sidste artikelNår kalium og fluorbinding er den slags?
Næste artikelHvad produceres, når et metal reagerer med syre?
 Varme artikler
Varme artikler
-
 Forskere udvikler ny chip til overlegen retsmedicinsk påvisning af blodresterBGU-mikrofluidchippen øger ikke kun den kemiluminescerende intensitet flere gange, men forlænger også luminols glødetid, muliggør påvisning af meget mindre blodprøver i en retsmedicinsk scene. Chipenh
Forskere udvikler ny chip til overlegen retsmedicinsk påvisning af blodresterBGU-mikrofluidchippen øger ikke kun den kemiluminescerende intensitet flere gange, men forlænger også luminols glødetid, muliggør påvisning af meget mindre blodprøver i en retsmedicinsk scene. Chipenh -
 Forskere opdrætter bakterier, der laver små højenergi-carbonringeEn kunstners skildring af et bakterielt enzym og den højenergiske kulstofring, det skabte. Kredit:Caltech Caltech-forskere har skabt en bakteriestamme, der kan lave små, men energipakkede carbonri
Forskere opdrætter bakterier, der laver små højenergi-carbonringeEn kunstners skildring af et bakterielt enzym og den højenergiske kulstofring, det skabte. Kredit:Caltech Caltech-forskere har skabt en bakteriestamme, der kan lave små, men energipakkede carbonri -
 Velcro-lignende madsensor registrerer fordærv og forureningDen velcro-lignende madsensor, lavet af en række silkemikronåle, kan stikke gennem plastikemballage for at prøve mad for tegn på fordærv og bakteriel forurening. Kredit:Felice Frankel MIT ingeniør
Velcro-lignende madsensor registrerer fordærv og forureningDen velcro-lignende madsensor, lavet af en række silkemikronåle, kan stikke gennem plastikemballage for at prøve mad for tegn på fordærv og bakteriel forurening. Kredit:Felice Frankel MIT ingeniør -
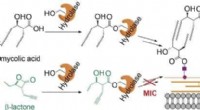 Antibakteriel beta-lacton infiltrerer mykomembranbiosyntesen og dræber tuberkulosepatogenKredit:Wiley Tuberkulose er en af de mest udbredte livstruende infektionssygdomme. Ikke alene gør antibiotikaresistens behandling stadig sværere, men bakteriernes relativt uigennemtrængelige myk
Antibakteriel beta-lacton infiltrerer mykomembranbiosyntesen og dræber tuberkulosepatogenKredit:Wiley Tuberkulose er en af de mest udbredte livstruende infektionssygdomme. Ikke alene gør antibiotikaresistens behandling stadig sværere, men bakteriernes relativt uigennemtrængelige myk
- Hvad er produktionen inden for videnskab?
- Efter at Chile har aflyst, verdens største klimamøde er nu uden hjem
- Hvad sker der med lysstyrken, når du ser på objekter under høj forstørrelse?
- Hvad var Nicholas bidrag til geologi?
- En ny online-beregner estimerer den sande værdi af aktier hos venture-støttede startups
- Videnskaben om statisk stød rykkede ind i det 21. århundrede


