Ved standardtrykket har en bestemt forbindelse lavt kogepunkt og er uopløselig i vand STP, dette eksisterer sandsynligvis som?
* lavt kogepunkt: Dette antyder svage intermolekylære kræfter mellem molekylerne i forbindelsen.
* uopløselig i vand: Dette indebærer, at forbindelsen er ikke-polær eller har meget svage interaktioner med vandmolekyler. Vand er et polært opløsningsmiddel, så det foretrækker at opløse andre polære molekyler.
* standardtryk (STP): Dette fortæller os bare de forhold, vi arbejder under, men det påvirker ikke direkte forbindelsen.
sætter det sammen:
I betragtning af ledetrådene er forbindelsen sandsynligvis et ikke-polært kovalent molekyle. Her er hvorfor:
* svage intermolekylære kræfter: Ikke-polære molekyler oplever primært svage London-spredningskræfter, som er ansvarlige for deres lave kogepunkter.
* uopløselighed i vand: Reglen "som opløser som" gælder her. Vand er polære, og ikke-polære molekyler tiltrækkes ikke af det, hvilket fører til uopløselighed.
Eksempler på sådanne forbindelser kunne omfatte:
* små kulbrinter: Som metan (CH4) og ethan (C2H6)
* Gasser: Der findes mange gasser som ikke-polære molekyler ved standardtryk (f.eks. Nitrogen (N2), ilt (O2))
Vigtig note: Der er undtagelser. Mens mange ikke-polære molekyler udviser disse egenskaber, kan nogle forbindelser have andre faktorer, der påvirker deres opførsel. For eksempel kunne et stort molekyle med en ikke-polær rygrad stadig have nogle polære funktionelle grupper, der kan føre til svag vandopløselighed.
 Varme artikler
Varme artikler
-
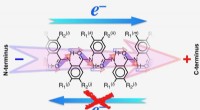 Elektroner tager et skridt fremad uden to skridt tilbageEn bioinspireret molekylær elektretdipol leder alle elektronerne mod den positive pol og forhindrer dem i at bevæge sig mod den negative pol. Kredit:Valentine Vullev Forskere ved University of Cal
Elektroner tager et skridt fremad uden to skridt tilbageEn bioinspireret molekylær elektretdipol leder alle elektronerne mod den positive pol og forhindrer dem i at bevæge sig mod den negative pol. Kredit:Valentine Vullev Forskere ved University of Cal -
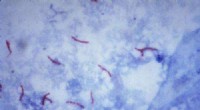 Papirbaseret tuberkulosetest kan øge diagnoser i udviklingslandeDette mikrofotografi afslører Mycobacterium tuberculosis-bakterier ved hjælp af syrefast Ziehl-Neelsen-farve; Forstørret 1000 X. De syrefaste pletter afhænger af mykobakteriers evne til at tilbagehold
Papirbaseret tuberkulosetest kan øge diagnoser i udviklingslandeDette mikrofotografi afslører Mycobacterium tuberculosis-bakterier ved hjælp af syrefast Ziehl-Neelsen-farve; Forstørret 1000 X. De syrefaste pletter afhænger af mykobakteriers evne til at tilbagehold -
 Structure-ID teknik kunne skifte kemi til fordrejningshastighedMichael Martynowycz, en postdoktor i Tamir Gonens laboratorium, køler en prøve med flydende nitrogen som forberedelse til et MicroED-eksperiment, der vil afsløre prøvens molekylære struktur. Kredit:Ta
Structure-ID teknik kunne skifte kemi til fordrejningshastighedMichael Martynowycz, en postdoktor i Tamir Gonens laboratorium, køler en prøve med flydende nitrogen som forberedelse til et MicroED-eksperiment, der vil afsløre prøvens molekylære struktur. Kredit:Ta -
 Nyt gennembrud i krigen mod antibiotikaresistensKredit:CC0 Public Domain Forskere ved University of Western Australia, i samarbejde med forskere i Canada, har udviklet en ny forbindelse, der kan bekæmpe antibiotikaresistente bakterier. B-lacta
Nyt gennembrud i krigen mod antibiotikaresistensKredit:CC0 Public Domain Forskere ved University of Western Australia, i samarbejde med forskere i Canada, har udviklet en ny forbindelse, der kan bekæmpe antibiotikaresistente bakterier. B-lacta


