Hvordan ville du finde svaret på dette spørgsmål Mange mol HCI kan dannes, når brintgas reagerer med klor?
* Kemiske reaktioner kræver afbalancerede ligninger: For at bestemme molen af det dannede produkt, har du brug for en afbalanceret kemisk ligning, der repræsenterer reaktionen. Reaktionen af brintgas (H₂) med chlorgas (CL₂) danner hydrogenchlorid (HCI), men vi er nødt til at kende * beløbet * for hver reaktant.
* Den begrænsende reaktant: Mængden af dannet produkt bestemmes af den begrænsende reaktant, som er den reaktant, der løber ud først. For at finde svaret skal du kende antallet af mol brintgas og klorgas reaktion.
Her er hvordan man løser et problem som dette:
1. Skriv den afbalancerede kemiske ligning:
H₂ (G) + Cl₂ (G) → 2 HCI (G)
2. Bestem molen for hver reaktant: Disse oplysninger vil blive givet i problemet (f.eks. "2 mol H₂ reagerer med 3 mol cl₂").
3. Identificer den begrænsende reaktant: Sammenlign molforholdet mellem reaktanterne og den afbalancerede ligningskoefficienter. Reaktanten med det mindre molforhold (i forhold til koefficienterne) er den begrænsende reaktant.
4. Beregn molen af produktet: Brug molforholdet fra den afbalancerede ligning til at bestemme molen af HCI, der er dannet baseret på molen af den begrænsende reaktant.
Eksempel:
Lad os sige, at vi har 2 mol H₂ og 3 mol Cl₂.
* Fra den afbalancerede ligning reagerer 1 mol H₂ med 1 mol CL₂ til dannelse af 2 mol HCI.
* Da vi har 2 mol H₂, ville det reagere med 2 mol CL₂ (ved hjælp af forholdet 1:1).
* Vi har dog 3 mol cl₂, så Cl₂ er i overskud. H₂ er den begrænsende reaktant.
* 2 mol H₂ ville producere 4 mol HCI (fordi forholdet fra den afbalancerede ligning er 1:2).
Derfor ville du være i stand til at danne 4 mol HCL i dette specifikke eksempel.
 Varme artikler
Varme artikler
-
 Mod sikrere bortskaffelse af printkortKredit:American Chemical Society Printplader er vitale komponenter i moderne elektronik. Imidlertid, når de har tjent deres formål, de bliver ofte brændt eller begravet på lossepladser, forurener
Mod sikrere bortskaffelse af printkortKredit:American Chemical Society Printplader er vitale komponenter i moderne elektronik. Imidlertid, når de har tjent deres formål, de bliver ofte brændt eller begravet på lossepladser, forurener -
 Æteriske oliekomponenter kan testes som lægemiddelkandidaterKredit:CC0 Public Domain Et forskerhold ved VIB-KU Leuven Center for Mikrobiologi og KU Leuven Biologisk Institut viste, at i modsætning til almindelig tro, de fleste komponenter i æteriske olier
Æteriske oliekomponenter kan testes som lægemiddelkandidaterKredit:CC0 Public Domain Et forskerhold ved VIB-KU Leuven Center for Mikrobiologi og KU Leuven Biologisk Institut viste, at i modsætning til almindelig tro, de fleste komponenter i æteriske olier -
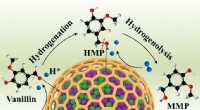 Indkapslede NiCo -legering nanopartikler, der katalyserer HDO -reaktionerEn indkapslet bimetallisk Ni-Co-legeringsstrategi er innovativt designet til at forbedre hydrodeoxygeneringsydelsen af biomassederivater til de tilsvarende methylerede produkter i vand. Kredit:Chine
Indkapslede NiCo -legering nanopartikler, der katalyserer HDO -reaktionerEn indkapslet bimetallisk Ni-Co-legeringsstrategi er innovativt designet til at forbedre hydrodeoxygeneringsydelsen af biomassederivater til de tilsvarende methylerede produkter i vand. Kredit:Chine -
 Hvor gamle forbindelser kunne blive morgendagens livreddereKredit:University of Leeds University of Leeds forskere ser tilbage i tiden på tidligere kasserede kemiske forbindelser, for at se, om der kunne udvikles nogen til nye antibiotika. I antibiotikau
Hvor gamle forbindelser kunne blive morgendagens livreddereKredit:University of Leeds University of Leeds forskere ser tilbage i tiden på tidligere kasserede kemiske forbindelser, for at se, om der kunne udvikles nogen til nye antibiotika. I antibiotikau
- Hvad er en As2O5-forbindelse?
- EPA annoncerer fly for at lede efter metan i Perm-bassinet
- Undersøgelse viser, at forsuring af havet har stor indvirkning på havlivet
- Hvor sikre er iPhone- og Android-apps
- Hvordan adskiller de generelle metoder til adskillelse af blandinger og forbindelser sig?
- Nedtælling til nul:Nyt nuldimensionelt kulstof nanorør kan føre til supertynde elektronik og synt…


