Skriv elektronkonfigurationen til AL?
1S² 2S² 2P⁶ 3S² 3P¹
Sådan forstår du det:
* 1S²: Det første energiniveau (n =1) har en underskal (er) med 2 elektroner.
* 2s²: Det andet energiniveau (n =2) har et 'S' underskal med 2 elektroner.
* 2p⁶: Det andet energiniveau har også et 'P' underskal, der kan holde op til 6 elektroner.
* 3S²: Det tredje energiniveau (n =3) har et 'S' underskal med 2 elektroner.
* 3p¹: Det tredje energiniveau har også et 'P' underskal, der har 1 elektron i aluminium.
Vigtig note: Aluminium har 13 elektroner. Elektronkonfigurationen følger Aufbau -princippet, der dikterer fyldning af orbitaler i rækkefølge af stigende energi.
 Varme artikler
Varme artikler
-
 Video:Små formskiftende polymerer udviklet til potentielle medicinske anvendelserKredit:Unsplash/CC0 Public Domain Ingeniører hos Caltech har udviklet en proces til generering af tredimensionelle arkitekterede polymerer med varmeafhængige formhukommelses egenskaber:Det vil sig
Video:Små formskiftende polymerer udviklet til potentielle medicinske anvendelserKredit:Unsplash/CC0 Public Domain Ingeniører hos Caltech har udviklet en proces til generering af tredimensionelle arkitekterede polymerer med varmeafhængige formhukommelses egenskaber:Det vil sig -
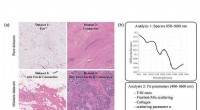 Fund bekræfter billeddannelsesteknikkernes evne til at skelne sundt væv efter neoadjuvant kemotera…95% bindevæv (datasæt 2), en blanding af fedt og bindevæv (datasæt 3) eller en blanding af tumorceller og bindevæv (datasæt 4). Kredit:Lisanne L. de Boer, Marie-Jeanne T.F.D. Vrancken Peeters, og F. v
Fund bekræfter billeddannelsesteknikkernes evne til at skelne sundt væv efter neoadjuvant kemotera…95% bindevæv (datasæt 2), en blanding af fedt og bindevæv (datasæt 3) eller en blanding af tumorceller og bindevæv (datasæt 4). Kredit:Lisanne L. de Boer, Marie-Jeanne T.F.D. Vrancken Peeters, og F. v -
 Enhed dirigerer sædcellerne til at gå imod strømmen for at hjælpe med infertilitetDen mikrofluidiske chip består af fire cylindriske kamre forbundet gennem mikrokanaler:væskeindløbskammeret, opsamlingskammeret, prøveindløbskammeret og affaldsopsamlingskammeret. Kredit:Florida Atlan
Enhed dirigerer sædcellerne til at gå imod strømmen for at hjælpe med infertilitetDen mikrofluidiske chip består af fire cylindriske kamre forbundet gennem mikrokanaler:væskeindløbskammeret, opsamlingskammeret, prøveindløbskammeret og affaldsopsamlingskammeret. Kredit:Florida Atlan -
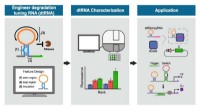 Lille teknik kan bringe store fremskridt inden for lægehjælpOvenstående grafik viser skemaer for en proces, der er central for forskning ledet af Xiao Wang og Alexander Green for at finde nye måder at genoprette menneskers sundhed ved at ombygge kroppens biome
Lille teknik kan bringe store fremskridt inden for lægehjælpOvenstående grafik viser skemaer for en proces, der er central for forskning ledet af Xiao Wang og Alexander Green for at finde nye måder at genoprette menneskers sundhed ved at ombygge kroppens biome
- NASA ser på nedbørsraterne i den tropiske cyklon Yvette
- Er der nogen sundhedsfarer forbundet med den måde, at atomkraftværker producerer energi?
- Team gør planetjagt til en gruppeindsats, finder mere end 100 kandidater
- Er det at få en solbrun kemisk reaktion?
- Forskere syntetiserer nanopartikler skræddersyet til specielle applikationer
- Hvad er et ægte verdenseksempel på en elastisk kollision?


