Hvad er den rigtige Lewis -struktur for fluor, som et gruppe 7A -element?
1. Bestem antallet af valenselektroner.
* Fluor er i gruppe 7a, så det har 7 valenselektroner .
2. Placer symbolet for elementet.
* Tegn bogstavet "F" for at repræsentere fluoratomet.
3. Distribuer valenselektroner rundt om atomet.
* Fluorbehov 8 elektroner for at opnå en stabil oktet.
* Start med at placere en dot På hver af de fire sider af symbolet "F".
* Tilføj derefter en dot Til hver side skal du parre dem med de eksisterende prikker. Du ender med tre par og en ensom prik .
Lewis -strukturen for fluor:
`` `
.
:F:
.
`` `
Vigtig note: Fluor er et meget elektronegativt element. Det er meget sandsynligt, at det får en elektron og danner en fluorionion (F-), som ville have en komplet oktet:
`` `
:F:
-
`` `
Sidste artikelHvilken farveflamme er natriumbromid?
Næste artikelArsen og silicium er ens, idet de begge er?
 Varme artikler
Varme artikler
-
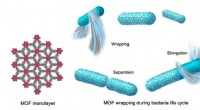 Rumdragter beskytter mikrober, der er bestemt til at leve i rummetEn 2D MOF vikler sig rundt om bakterierne for at danne en blød kappe, der udvider sig, efterhånden som bakterierne vokser og deler sig. MOF beskytter dem mod ilt, bagsiden af en rumdragt, som beskyt
Rumdragter beskytter mikrober, der er bestemt til at leve i rummetEn 2D MOF vikler sig rundt om bakterierne for at danne en blød kappe, der udvider sig, efterhånden som bakterierne vokser og deler sig. MOF beskytter dem mod ilt, bagsiden af en rumdragt, som beskyt -
 Nye 2-D spektroskopi metoderI EEI2D spektroskopi (venstre), to oprindeligt adskilte excitationer (gule pile) mødes. Med 2D massespektrometri (højre), ionfotoprodukter (sorte pile) detekteres. Kredit:Tobias Brixner, JMU Sæt e
Nye 2-D spektroskopi metoderI EEI2D spektroskopi (venstre), to oprindeligt adskilte excitationer (gule pile) mødes. Med 2D massespektrometri (højre), ionfotoprodukter (sorte pile) detekteres. Kredit:Tobias Brixner, JMU Sæt e -
 En metode til computerstøttet modellering og simulering af store proteiner og andre biomolekylerKredit:CC0 Public Domain To computerforskere ved Freie Universität Berlin ændrer måden, store proteiner modelleres inde i computere ved at kombinere maskinlæring, et område med kunstig intelligens
En metode til computerstøttet modellering og simulering af store proteiner og andre biomolekylerKredit:CC0 Public Domain To computerforskere ved Freie Universität Berlin ændrer måden, store proteiner modelleres inde i computere ved at kombinere maskinlæring, et område med kunstig intelligens -
 Analyse af biologiske og kemiske skader på byggematerialer fra det 20. århundredeDr. Iratxe Ibarrondo bruger bærbare højopløsningsspektroskopiske teknikker til at analysere påvirkningen på det 20. århundredes byggematerialer af miljøet og de biologiske forhold i det omkringliggend
Analyse af biologiske og kemiske skader på byggematerialer fra det 20. århundredeDr. Iratxe Ibarrondo bruger bærbare højopløsningsspektroskopiske teknikker til at analysere påvirkningen på det 20. århundredes byggematerialer af miljøet og de biologiske forhold i det omkringliggend


