Hvorfor er chlormethan mere polær end metan?
Her er hvorfor:
* Elektronegativitet: Klor er mere elektronegativ end kulstof. Dette betyder, at klor har en stærkere attraktion for elektroner i C-CL-bindingen.
* polær binding: Den ulige deling af elektroner i C-CL-bindingen skaber en delvis negativ ladning (Δ-) på kloratomet og en delvis positiv ladning (Δ+) på carbonatomet. Dette skaber et dipolmoment I molekylet.
* molekylær geometri: Chlormethan har en tetrahedral form, med chloratomet placeret asymmetrisk. Denne form kombineret med dipolmomentet resulterer i et netto dipolmoment for hele molekylet.
I modsætning hertil har metan kun kulstof-hydrogenbindinger. Hydrogen og kulstof har lignende elektronegativitetsværdier, så C-H-bindingerne er i det væsentlige ikke-polære. Da der ikke er nogen signifikante polære bindinger, har metan ikke noget samlet dipolmoment og er et ikke -polært molekyle.
Kortfattet: Chlormethan har en polær C-CL-binding og et netto dipolmoment på grund af dets molekylære geometri, hvilket gør det til et polært molekyle. Metan har ingen signifikante polære bindinger og intet netto dipolmoment, hvilket gør det til et ikke -polært molekyle.
Sidste artikelHvad er bølgelængden af kaliumchlorid?
Næste artikelHvad er formlen for natriumhalogenid?
 Varme artikler
Varme artikler
-
 Forskere efterligner neuralt vævNyt banebrydende materiale kan føre til fremtidig autonom blød robotteknologi, dobbelte sensorer og aktuatorer til bløde eksoskeletter, eller kunstigt skind. Kredit:U.S. Army Research Laboratory U
Forskere efterligner neuralt vævNyt banebrydende materiale kan føre til fremtidig autonom blød robotteknologi, dobbelte sensorer og aktuatorer til bløde eksoskeletter, eller kunstigt skind. Kredit:U.S. Army Research Laboratory U -
 Aske fra kraftværker forarbejdet til reagenser til vandrensningKredit:CC0 Public Domain Russiske metallurger har foreslået at opløse askeaffaldet fra termiske kraftværker med saltsyre ved højt tryk. De resulterende forbindelser kan anvendes til vandbehandling
Aske fra kraftværker forarbejdet til reagenser til vandrensningKredit:CC0 Public Domain Russiske metallurger har foreslået at opløse askeaffaldet fra termiske kraftværker med saltsyre ved højt tryk. De resulterende forbindelser kan anvendes til vandbehandling -
 Innovativ forarbejdning og emballering for sikker, høj kvalitet, økologiske bærprodukterKredit:Stanislav Samoylik, Shutterstock I løbet af de sidste to årtier, der har været stigende bekymring for de negative virkninger af konventionelt dyrkede produkter på vores sundhed og miljøet.
Innovativ forarbejdning og emballering for sikker, høj kvalitet, økologiske bærprodukterKredit:Stanislav Samoylik, Shutterstock I løbet af de sidste to årtier, der har været stigende bekymring for de negative virkninger af konventionelt dyrkede produkter på vores sundhed og miljøet. -
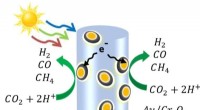 Soldrevet kemi bruger kuldioxid og vand til at fremstille råmaterialer til brændstoffer, kemikalie…Et diagram over halvledernannotrådene lavet af indium, gallium og nitrogen - dekoreret med guld- og kromoxidnanopartikler. Når lyset rammer nanotråden, frigør det elektroner og de positivt ladede hull
Soldrevet kemi bruger kuldioxid og vand til at fremstille råmaterialer til brændstoffer, kemikalie…Et diagram over halvledernannotrådene lavet af indium, gallium og nitrogen - dekoreret med guld- og kromoxidnanopartikler. Når lyset rammer nanotråden, frigør det elektroner og de positivt ladede hull
- Vulkanisk aske kan hjælpe med at reducere kuldioxid i forbindelse med klimaændringer
- Hvordan kan strømning af varmeenergi i manteleffekten klippemateriale?
- Hvad skaber jordmagnegtisk felt?
- Hvor tyk er hvert lag af jorden?
- Hvilken antarktisk base blev etableret af Richard E. Byrd?
- Hvilke sætninger beskriver bedst forskellige baner, som elektroner kan optage?


