Er svovl en kation eller anion?
Her er hvorfor:
* Elektronkonfiguration: Svovl har 6 valenselektroner (elektroner i sin yderste skal). Det skal få 2 flere elektroner for at opnå en stabil oktet (8 elektroner).
* iondannelse: For at opnå stabilitet har svovl en tendens til at vinde 2 elektroner og danne en sulfidion (S²⁻).
Mens svovl også kan danne kationer i nogle sjældne tilfælde (som S⁴⁺), er det meget mere almindeligt, at det fungerer som en anion.
 Varme artikler
Varme artikler
-
 Kemisk syntese med kunstig intelligens:Forskere udvikler ny computermetodeKredit:CC0 Public Domain I 1996 da en computer vandt en kamp mod den regerende verdensmester i skak, Garry Kasparov, det var intet mindre end en fornemmelse. Efter dette gennembrud i skakverdenen,
Kemisk syntese med kunstig intelligens:Forskere udvikler ny computermetodeKredit:CC0 Public Domain I 1996 da en computer vandt en kamp mod den regerende verdensmester i skak, Garry Kasparov, det var intet mindre end en fornemmelse. Efter dette gennembrud i skakverdenen, -
 Verdens ældste periodiske diagram fundet i St. AndrewsPeriodisk bordvaskebehandling. Kredit:University of St. Andrews Et periodisk tabeldiagram opdaget ved University of St Andrews menes at være det ældste i verden. Diagrammet af elementer, stammer
Verdens ældste periodiske diagram fundet i St. AndrewsPeriodisk bordvaskebehandling. Kredit:University of St. Andrews Et periodisk tabeldiagram opdaget ved University of St Andrews menes at være det ældste i verden. Diagrammet af elementer, stammer -
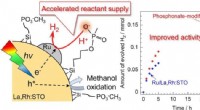 Øget fotokatalyse for hydrogenudvikling:Reaktantforsyning gennem phosphonatgrupperSkematisk illustration af alkylsilanphosphonatmodifikationen af en Ru/La, Rh:STO fotokatalysator for at fremskynde reaktantforsyningen. Kredit:© 2020 Yosuke Kageshima, Shinshu universitet Forskn
Øget fotokatalyse for hydrogenudvikling:Reaktantforsyning gennem phosphonatgrupperSkematisk illustration af alkylsilanphosphonatmodifikationen af en Ru/La, Rh:STO fotokatalysator for at fremskynde reaktantforsyningen. Kredit:© 2020 Yosuke Kageshima, Shinshu universitet Forskn -
 Kobber og PTFE holder sammen for at understøtte bedre 5G(a) Fotografi af den ekstremt glatte Cu -folie og dens overfladebillede. (b) Fotografi af Cu folie/PTFE -enheden under 90 ° skrælningstesten. Kredit:M. Nishino et al. Mængden af digital kommunik
Kobber og PTFE holder sammen for at understøtte bedre 5G(a) Fotografi af den ekstremt glatte Cu -folie og dens overfladebillede. (b) Fotografi af Cu folie/PTFE -enheden under 90 ° skrælningstesten. Kredit:M. Nishino et al. Mængden af digital kommunik
- Forskere designer enklere magneter til snoede faciliteter, der kan føre til steady-state fusionsdri…
- Holocæn temperatur på Den Iberiske Halvø rekonstrueret med insektunderfossiler
- Hvilken rolle spiller en Woodlouse i nedbrydning?
- Forskere skaber superafvisende overflademateriale (m/ video)
- Hvordan udvikler embryoet sig til foster?
- Negativ nyhedsdækning styrker kollektiv handling i minoriteter


