Hvorfor er bindingsvinklerne i vand og ammoniak mindre end den ideelle værdi på 109,5?
Her er en sammenbrud:
vand (H₂O):
* Oxygen har to ensomme par elektroner og to bindingspar med brintatomer.
* Enlige par udøver en stærkere frastødende kraft end bindingspar på grund af deres større elektrondensitet og mindre lokaliseret natur.
* Denne frastødelse tvinger bindingsparene tættere sammen, hvilket resulterer i en mindre bindingsvinkel på 104,5 ° .
ammoniak (NH₃):
* Nitrogen har et ensomt par og tre bindingspar med brintatomer.
* Det ensomme par skubber igen bindingsparene tættere sammen, hvilket reducerer bindingsvinklen til 107 ° .
Kortfattet:
Tilstedeværelsen af ensomme par på det centrale atom i vand og ammoniak fører til et fald i bindingsvinklen sammenlignet med den ideelle tetrahedrale vinkel. Dette skyldes, at ensomme par har en større frastødende kraft end bindingspar, hvilket tvinger bindingsparene tættere sammen.
Sidste artikelEr svovl en kation eller anion?
Næste artikelEr nitrogendioxidopløselig i vand?
 Varme artikler
Varme artikler
-
 Farverig løsning på en flaskehals i den kemiske industriOpløsninger af organiske farvestofmolekyler kan let adskilles af membranen med to mellemrum. Kredit:KAUST; Anastasia Khrenova De nanoskala vandkanaler, som naturen har udviklet til hurtigt at tran
Farverig løsning på en flaskehals i den kemiske industriOpløsninger af organiske farvestofmolekyler kan let adskilles af membranen med to mellemrum. Kredit:KAUST; Anastasia Khrenova De nanoskala vandkanaler, som naturen har udviklet til hurtigt at tran -
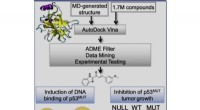 Ny undersøgelse afslører en beregningsstyret tilgang til at undertrykke kræfttumorvækstGrafisk abstrakt. Kredit:Geetha Durairaj et al., Cell Chemical Biology (2022). DOI:10.1016/j.chembiol.2022.07.003 En ny undersøgelse, ledet af forskere fra University of California, Irvine og Unive
Ny undersøgelse afslører en beregningsstyret tilgang til at undertrykke kræfttumorvækstGrafisk abstrakt. Kredit:Geetha Durairaj et al., Cell Chemical Biology (2022). DOI:10.1016/j.chembiol.2022.07.003 En ny undersøgelse, ledet af forskere fra University of California, Irvine og Unive -
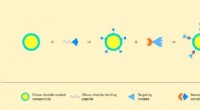 Forskere udvikler molekylær samlingsmetode til kræftterapi og diagnostikIllustration af samlingen af strukturen baseret på en nanopartikel og protein-komplekset barnase-barstar. Kredit:Forfattere af papiret og Lion_on_helium, MIPT Biofysikere har udviklet en metode
Forskere udvikler molekylær samlingsmetode til kræftterapi og diagnostikIllustration af samlingen af strukturen baseret på en nanopartikel og protein-komplekset barnase-barstar. Kredit:Forfattere af papiret og Lion_on_helium, MIPT Biofysikere har udviklet en metode -
 Mikrobrygning går mere mikro(L-R) Ed Kerr og Dr. Ben Schulz har krympet kritiske øleksperimenter, potentielt fører til nye ølsorter. Kredit:Ho Vu En ph.d. studerende og ølforsker har uforvarende opdaget en måde at udføre eks
Mikrobrygning går mere mikro(L-R) Ed Kerr og Dr. Ben Schulz har krympet kritiske øleksperimenter, potentielt fører til nye ølsorter. Kredit:Ho Vu En ph.d. studerende og ølforsker har uforvarende opdaget en måde at udføre eks


