Forskere udvikler molekylær samlingsmetode til kræftterapi og diagnostik
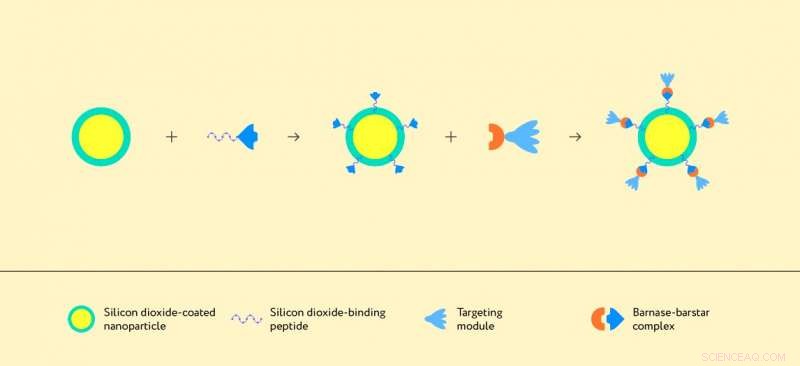
Illustration af samlingen af strukturen baseret på en nanopartikel og protein-komplekset barnase-barstar. Kredit:Forfattere af papiret og Lion_on_helium, MIPT
Biofysikere har udviklet en metode til at ændre overfladen af mikro- og nanopartikler- små strukturer, der måler mellem en tusindedel og en milliontedel af en millimeter- ved at dække dem med biologiske molekyler. Konstrueret på denne måde, partiklerne kan tjene som både terapeutiske og diagnostiske midler, levere medicin til kræftceller.
Avisen blev offentliggjort i tidsskriftet ACS -anvendte materialer og grænseflader . Dets forfattere er forskere fra Moscow Institute of Physics and Technology (MIPT), instituttet for bioorganisk kemi ved det russiske videnskabsakademi (IBCh RAS), National Research Nuclear University MEPhI, Sechenov Universitet, og Macquarie University (Australien).
Omkring 1900, Paul Ehrlich, vinderen af 1908 Nobelprisen i fysiologi eller medicin, forestillede sig lægemidler, der ville have en komponent, der genkender patogener i kroppen og en anden komponent, der virker på målet. Som regel, sådanne lægemidler retter sig mod receptorer på overfladen af de beskadigede celler. Disse receptorer tillader også midlet at genkende cellen. Et universelt system af denne art kan bruges til diagnostik, terapi, eller begge. Når terapi og diagnostik kombineres, dette er kendt som teranostik.
For at lave et system, der indeholder en terapeutisk og en diagnostisk komponent, en "molekylær lim" er nødvendig for at holde de to dele sammen. Denne lim kan realiseres som proteiner, der er i stand til at danne et stabilt kompleks ved at binde til hinanden. Et af de mest stabile komplekser af denne slags er proteinet barnase-barstar protein. Der er en værdi kendt som bindingskonstanten, der karakteriserer, hvor stærkt molekylerne i et kompleks er koblet. Bindingskonstanten for barnase-barstar-komplekset er 1, 000 til 1 million gange større end antigen-antistofkompleksernes, som er grundlaget for vores immunrespons.
Barnase og barstar kan bruges til at konstruere forskellige funktionelle moduler til teranostik. For eksempel, barnase kan bindes til terapeutiske midler - antistoffer, medicin, fluorescerende molekyler, osv. - mens barstar kan smeltes sammen med et målretningsmiddel. Dette koncept blev foreslået af Sergey Deyev, leder af Molecular Immunology Laboratory i IBCh RAS. De to moduler kombineres derefter, danner en bifunktionel forbindelse, som har terapeutiske og diagnostiske egenskaber, og muliggør målrettet levering af lægemidler. Ved at fusionere barnase og barstar med forskellige terapeutiske og diagnostiske molekyler, forskere kan udvikle en række theranostiske midler baseret på det samme princip. Disse molekylære strukturer kan bæres på overfladen af nano- eller mikropartikler. Partiklerne selv kan have hjælpeegenskaber, herunder fluorescens eller evnen til at blive ødelagt, når den udsættes for stråling dræber de omkringliggende skadelige celler, såsom kræftceller. Snesevis af molekylære strukturer af forskellige typer kan aflejres på en lille partikel, potentielt øger dets terapeutiske virkninger.

Illustration af princippet om teranostisk struktur. Kredit:Forfattere af papiret og Lion_on_helium, MIPT
Molekylært montagesæt
Forestillingen om at bruge nano- og mikropartikler til at levere medicin undersøges aktivt i mange laboratorier. De russiske og australske forskere udviklede et nanopartikelbaseret theranostisk middel ved hjælp af barnase-barstar proteinkompleks og studerede dets egenskaber.
"De fleste af de metoder, der i øjeblikket bruges til kemisk kobling af biomolekyler til nanopartikler, har alvorlige fejl, "siger hovedforfatter Victoria Shipunova, en forsker ved MIPT's Nanobiotechnology Lab og en seniorforsker ved Molecular Immunology Lab ved Institute of Bioorganic Chemistry. "Biomolekylernes rumlige orientering er dårligt kontrolleret, og de støder på problemer, når de binder sig til deres mål. Tætheden af de koblede molekyler er temmelig lav, og proceduren er tidskrævende. "
"Vi udviklede en metode baseret på barnase-barstar-proteinparret, der ikke ændrer den rumlige struktur af målmolekylerne. To yderligere fordele er dens høje specificitet og hurtige kobling:Det tager kun flere minutter for alle moduler at binde, ”forklarer hun.
Forskerne brugte siliciumdioxidovertrukne partikler som bærere til deres molekylære kompleks. De primære mål for biostrukturer beskrevet i avisen er kræftceller, identificeres af HER2/neu oncomarker på deres overflade, vist som en rød udvækst i figur 2. HER2/neu er et protein, der er ansvarligt for cellevækst og deling og findes i raske celler. I kræftceller, imidlertid, dette protein er i overskud - eller overudtrykt - så de kan vokse og dele sig ukontrollabelt.
Forskerne brugte et molekyle fra klassen af designede ankyrin -gentagelsesproteiner, eller DARPins, som målretningsmiddel, der genkender HER2/neu -proteinet. Vist som lyseblå klokkeblomstformede strukturer i figur 1 og 2, DARPins er små og meget stabile proteiner, der selektivt kan binde til målmolekylet. Udover et DARPin -molekyle, som genkender kræftceller, strukturen skal inkorporere et molekyle, der er i stand til at binde sig til bærerpartikelens overflade - det vil sige til siliciumdioxid. For det, forskerne brugte et siliciumdioxidbindende peptid opnået ved rationelt design ved Macquarie University. Som resultat, de skabte følgende struktur:En nano- eller mikropartikel er belagt med siliciumdioxid, hvortil barnase-DARPin-modulet er knyttet via siliciumdioxidbindende peptid smeltet med barstar (figur 1). Vigtigere, hvert af de involverede elementer kan ændres eller endda udskiftes, ændring af egenskaberne af den overordnede struktur. På en måde, det ligner et molekylær byggesæt, som kan samles på mange måder, fremstilling af forskellige terapeutiske midler.
Træde i kræft, forskerne har skabt en universel samlingsmetode, som gør det let at kombinere et antal molekyler med terapeutisk og diagnostisk potentiale, samtidig bevare deres rumlige struktur og egenskaber.
 Varme artikler
Varme artikler
-
 Del og erobre:Forskere finder nøglen til at skabe bedre medicin med færre bivirkningerChiralt molekyle. Kredit:Palitel og Naaman. I dag, en ny undersøgelse offentliggjort i Videnskab af professorer Yossi Paltiel fra det hebraiske universitet i Jerusalem og Ron Naaman fra Weizmann
Del og erobre:Forskere finder nøglen til at skabe bedre medicin med færre bivirkningerChiralt molekyle. Kredit:Palitel og Naaman. I dag, en ny undersøgelse offentliggjort i Videnskab af professorer Yossi Paltiel fra det hebraiske universitet i Jerusalem og Ron Naaman fra Weizmann -
 Forskere sender DNA på sekventiel byggemissionEt hold videnskabsmænd har udviklet en metode til at skabe strukturer, hvis byggesten er en milliontedel af en meter store ved at kode DNA med monteringsvejledninger. I en række eksperimenter, forsker
Forskere sender DNA på sekventiel byggemissionEt hold videnskabsmænd har udviklet en metode til at skabe strukturer, hvis byggesten er en milliontedel af en meter store ved at kode DNA med monteringsvejledninger. I en række eksperimenter, forsker -
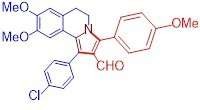 En række stoffer med antitumor -egenskaber syntetiseretStrukturen af en af de resulterende forbindelser (2-aryl-5, 6-dihydropyrrolo [2, 1-α] isoquinoline) Kredit:Maria Matveeva Forskere fra RUDN University har syntetiseret en række nye cytotoksisk
En række stoffer med antitumor -egenskaber syntetiseretStrukturen af en af de resulterende forbindelser (2-aryl-5, 6-dihydropyrrolo [2, 1-α] isoquinoline) Kredit:Maria Matveeva Forskere fra RUDN University har syntetiseret en række nye cytotoksisk -
 Teknik til at skabe medicin fri for bivirkningerJ. Julius Zhu sagde, at hovedideen bag forskningen var faktisk meget enkel, men det tog os mange år at få denne ting til at fungere. Kredit:Dan Addison, Universitetets kommunikation En ny teknik
Teknik til at skabe medicin fri for bivirkningerJ. Julius Zhu sagde, at hovedideen bag forskningen var faktisk meget enkel, men det tog os mange år at få denne ting til at fungere. Kredit:Dan Addison, Universitetets kommunikation En ny teknik
- Spanien:Taxachauffører blokerer gaderne over kørselstjenester
- IAU godkender 86 nye stjernenavne fra hele verden
- Hvad er coterminale vinkler?
- Korrosion og kemiske ændringer i aluminium Metal
- Nye forskningsstridigheder hævder, at klimaændringer udløste den syriske borgerkrig
- Byer, der ikke bygger op, da højhuse når deres sidste anvendelsesdato


