Når en dichromation fungerer, når et oxidationsmiddel oxidationstilstand falder fra?
Her er hvorfor:
* dichromate ion (cr₂o₇²⁻): Oxidationstilstanden for krom i dichromat er +6.
* krom (III) ion (CR³⁺): Dette er den almindelige reducerede form for krom, når dichromat fungerer som et oxidationsmiddel.
reaktionen:
I typiske reaktioner reduceres dichromationer til krom (III) -ioner. For eksempel i sur opløsning:
Cr₂o₇²⁻ (aq) + 14H⁺ (aq) + 6e⁻ → 2cr³⁺ (aq) + 7h₂o (l)
Her får hvert kromatom 3 elektroner, hvilket får dets oxidationstilstand til at falde fra +6 til +3.
 Varme artikler
Varme artikler
-
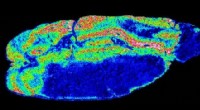 Konjugerede polymerer forbedrer massespektrometri og billeddannelseblå). Kredit:American Chemical Society Forbedringer i, hvordan prøver fremstilles, vil tilføje rækkevidde og fleksibilitet til en metode, der detekterer placeringen af udvalgte molekyler i en bi
Konjugerede polymerer forbedrer massespektrometri og billeddannelseblå). Kredit:American Chemical Society Forbedringer i, hvordan prøver fremstilles, vil tilføje rækkevidde og fleksibilitet til en metode, der detekterer placeringen af udvalgte molekyler i en bi -
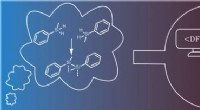 Forskere først til at forbinde silicium atomer på overfladerSkematisk repræsentation af de involverede discipliner (i midten) og transformationen af ideen (venstre) til det endelige produkt (højre). I baggrunden til højre er et scanning tunneling mikroskop b
Forskere først til at forbinde silicium atomer på overfladerSkematisk repræsentation af de involverede discipliner (i midten) og transformationen af ideen (venstre) til det endelige produkt (højre). I baggrunden til højre er et scanning tunneling mikroskop b -
 Spændende ny udvikling for polymerer fremstillet af affaldssvovlHavnefrontens svovlbunke om natten, Vancouver havn. Kredit:University of Liverpool Forskere ved University of Liverpool gør betydelige fremskridt i søgen efter at udvikle nye svovlpolymerer, der g
Spændende ny udvikling for polymerer fremstillet af affaldssvovlHavnefrontens svovlbunke om natten, Vancouver havn. Kredit:University of Liverpool Forskere ved University of Liverpool gør betydelige fremskridt i søgen efter at udvikle nye svovlpolymerer, der g -
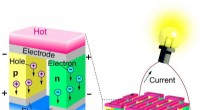 Flere halvleder type switch til at øge termoelektrisk konvertering af spildvarmeTinmonoselenid (SnSe), når dopet med antimon (Sb), kan danne en egnet kandidat til design af termoelektriske konverteringselementer (p-n-forbindelsesenhed). Kredit:Tokyo Tech I de seneste år, ener
Flere halvleder type switch til at øge termoelektrisk konvertering af spildvarmeTinmonoselenid (SnSe), når dopet med antimon (Sb), kan danne en egnet kandidat til design af termoelektriske konverteringselementer (p-n-forbindelsesenhed). Kredit:Tokyo Tech I de seneste år, ener
- Hvad kaldes det, når Atom har en positiv eller negativ ladning?
- I et system, hvor energi omdannes fra en form til en anden?
- Navngiv planeterne, der har en atmosfære, der er åndbar af mennesker?
- Forskere afslører, hvordan organismer undgår kulilteforgiftning
- G20:Kompromis om klimaændringer, men til hvilken pris?
- Hvilke fire store vandmasser berører den arabiske halvø?


