Hvorfor er massivt natrium en fremragende leder af elektricitet, men chloridisolator?
natrium (NA) - En god leder
* Metallisk binding: Natrium er et metal, og metaller er kendetegnet ved metallisk binding. I denne type binding holdes de yderste elektroner af atomerne løst og kan bevæge sig frit gennem metalgitteret. Disse "frie elektroner" er nøglen til ledningsevne.
* Elektronmobilitet: Når et elektrisk felt påføres natrium, kan disse frie elektroner let migrere som svar på feltet. Denne bevægelse af ladning udgør en elektrisk strøm, hvilket gør natrium til en fremragende leder.
chlorid (CL) - En isolator
* ionisk binding: Chlorid findes som en ion (Cl-), typisk i ioniske forbindelser som natriumchlorid (NaCl). Ved ionisk binding overføres elektroner fra et atom til et andet, idet de danner ioner med modsatte ladninger, der er stærkt tiltrukket af hinanden.
* faste elektroner: Elektronerne i chloridioner er tæt bundet inden for den ioniske struktur. De er ikke frie til at bevæge sig let i modsætning til de frie elektroner i metaller.
* Ingen gratis luftfartsselskaber: Uden frie elektroner til at bære ladning kan chlorid ikke udføre elektricitet effektivt, hvilket gør det til en isolator.
Kortfattet
Den grundlæggende forskel i konduktivitet mellem natrium og chlorid ligger i deres bindingsstrukturer og opførslen af deres elektroner:
* natrium: Metallisk binding med frie elektroner muliggør høj ledningsevne.
* chlorid: Ionisk binding med tæt bundne elektroner forhindrer betydelig ladningsbevægelse, hvilket resulterer i isolerende opførsel.
 Varme artikler
Varme artikler
-
 Kigger influenza-pandemier i opløbetForskere er ved at udvikle en engangs letanvendelig influenzadetektor, der giver synlige resultater (indsat) på cirka 35 minutter. Kredit:American Chemical Society Truslen om en større influenzapa
Kigger influenza-pandemier i opløbetForskere er ved at udvikle en engangs letanvendelig influenzadetektor, der giver synlige resultater (indsat) på cirka 35 minutter. Kredit:American Chemical Society Truslen om en større influenzapa -
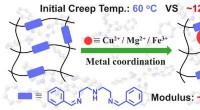 Metalkoordination muliggør høj temperatur, krybe-resistent polyimin vitrimer præparatLet forberedelse af polyimin vitrimere med forbedret krybebestandighed, termiske og mekaniske egenskaber via metalkoordination. Kredit:NIMTE Den biobaserede polymergruppe ved Ningbo Institute of M
Metalkoordination muliggør høj temperatur, krybe-resistent polyimin vitrimer præparatLet forberedelse af polyimin vitrimere med forbedret krybebestandighed, termiske og mekaniske egenskaber via metalkoordination. Kredit:NIMTE Den biobaserede polymergruppe ved Ningbo Institute of M -
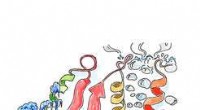 En teoretisk undersøgelse forklarer det naturlige udvalg af proteinerKunstnerisk repræsentation af sekvensudvælgelsen efter temperatur for et hydratiseret protein. Kredit:V. Bianco Forskere fra Institute of Nanoscience and Nanotechnology ved University of Barcelona
En teoretisk undersøgelse forklarer det naturlige udvalg af proteinerKunstnerisk repræsentation af sekvensudvælgelsen efter temperatur for et hydratiseret protein. Kredit:V. Bianco Forskere fra Institute of Nanoscience and Nanotechnology ved University of Barcelona -
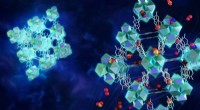 Forskere bygger mikroporøse MOF-fælder til at afbøde giftige gasserKredit:Oak Ridge National Laboratory Nitrogendioxid og svovldioxid (NO2 og SO2 ) er giftige gasser, der er skadelige for miljøet og menneskers sundhed. Når de kommer ind i atmosfæren, kan de rejse
Forskere bygger mikroporøse MOF-fælder til at afbøde giftige gasserKredit:Oak Ridge National Laboratory Nitrogendioxid og svovldioxid (NO2 og SO2 ) er giftige gasser, der er skadelige for miljøet og menneskers sundhed. Når de kommer ind i atmosfæren, kan de rejse
- Undersøgelse kaster nyt lys over, hvordan cellulære transportsystemer udnytter energi til at udfø…
- Bor i fantasiland? Held er vigtigere end fantasisportsspillere tror
- Hvilket stof ville varmeoverførsel ved ledning fungere bedst?
- Hvilket udtryk definerer noget, der ikke overfører termisk energi effektivt?
- Krybskytteri i elfenben på kritiske niveauer:Elefanter på vej mod udryddelse i 2020?
- Hvad er den nemmeste biome at lave et videnskabsprojekt på?


