Gør alle isotoper af et element fra de samme type ioner?
* isotoper: Isotoper af et element har det samme antal protoner (atomnummer) men forskellige antal neutroner. Dette betyder, at de har det samme antal elektroner i deres neutrale tilstand, men deres massetal er forskellige.
* ionisering: Ionisering involverer forstærkning eller tab af elektroner. Et atoms tendens til at danne en specifik ion bestemmes stort set af dens elektronkonfiguration, især antallet af valenselektroner (elektroner i den yderste skal).
* Elektronkonfiguration: Mens isotoper har den samme elektronkonfiguration i deres neutrale tilstand, kan tilstedeværelsen af forskellige antal neutroner subtilt påvirke stabiliteten af kernen og følgelig elektroners energiniveau. Denne forskel kan undertiden føre til variationer i den lethed, hvormed en isotop mister eller får elektroner.
Eksempel:
* carbon-12 (¹²c) og carbon-14 (¹⁴c) er begge isotoper af kulstof.
* ¹²c er den mest almindelige isotop og danner let en +4 kation (C⁴⁺) i forbindelser.
* ¹⁴c , mens den stadig er carbon, kan udvise lidt anden ioniseringsadfærd på grund af tilstedeværelsen af to ekstra neutroner. Selvom det stadig kan danne kationer, kan dens tendens til at gøre det være lidt anderledes.
Kortfattet:
Mens isotoper af et element deler de samme kemiske egenskaber på grund af at have det samme antal protoner og elektroner, kan de subtile nukleare forskelle indført ved forskellige neutronantal undertiden påvirke deres ioniseringstendenser. Dette betyder, at selvom de fleste isotoper vil danne de samme typer ioner, kan der være subtile variationer i deres ioniseringsadfærd.
 Varme artikler
Varme artikler
-
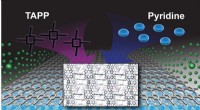 En bedre byggesten til at skabe nye materialerEn grafisk repræsentation af de kovalente organiske rammer, eller COFer, skabt af et samarbejdende team af eksperimentelle og teoretiske kemikere. Store porphyrinstrukturer (mærket som TAPP) danner et
En bedre byggesten til at skabe nye materialerEn grafisk repræsentation af de kovalente organiske rammer, eller COFer, skabt af et samarbejdende team af eksperimentelle og teoretiske kemikere. Store porphyrinstrukturer (mærket som TAPP) danner et -
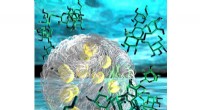 Syntetisk organel viser, hvordan bittesmå vandpytter-organer i vores celler fungererEn illustration af en del af en syntetisk organel uden membran. Her ser vi to lag, der fase adskilles som olie og vand, men begge lag er vand. Der er ingen olie. Hvert lag indeholder et andet opløst s
Syntetisk organel viser, hvordan bittesmå vandpytter-organer i vores celler fungererEn illustration af en del af en syntetisk organel uden membran. Her ser vi to lag, der fase adskilles som olie og vand, men begge lag er vand. Der er ingen olie. Hvert lag indeholder et andet opløst s -
 Protocellgæster flygter fra redenKonfokal fluorescensmikroskopibillede, der viser et tværsnit af en vært-gæst nestet protocelle bestående af et fanget gæstproteinosom (grønt), der er fanget inde i en vært-coacervat mikrodråbe (rød).
Protocellgæster flygter fra redenKonfokal fluorescensmikroskopibillede, der viser et tværsnit af en vært-gæst nestet protocelle bestående af et fanget gæstproteinosom (grønt), der er fanget inde i en vært-coacervat mikrodråbe (rød). -
 Kemisk sensor på basis af materialer, der besidder molekylær hukommelseEn kemisk sensor på basis af materialer, der besidder molekylær hukommelse. Kredit:Vita Nikitina Forskere fra det kemiske fakultet ved Lomonosov Moscow State University har udviklet en polymerbase
Kemisk sensor på basis af materialer, der besidder molekylær hukommelseEn kemisk sensor på basis af materialer, der besidder molekylær hukommelse. Kredit:Vita Nikitina Forskere fra det kemiske fakultet ved Lomonosov Moscow State University har udviklet en polymerbase


