Hvor mange gram kuldioxid ville blive produceret, hvis 45 g C6H12O6 konkurrerede med ilt?
1. Afbalanceret kemisk ligning:
Den afbalancerede kemiske ligning for forbrænding af glukose (C6H12O6) er:
C6H12O6 + 6O2 → 6CO2 + 6H2O
2. Molforhold:
Ligningen viser, at 1 mol glukose (C6H12O6) reagerer for at producere 6 mol kuldioxid (CO2).
3. Konverter gram til mol:
* glukose:
* Molmasse af C6H12O6 =(6 * 12,01 g/mol) + (12 * 1,01 g/mol) + (6 * 16,00 g/mol) =180,18 g/mol
* Mol glukose =(45 g) / (180,18 g / mol) =0,25 mol
4. Beregn mol af kuldioxid:
* Brug af molforholdet fra den afbalancerede ligning:
* Mol CO2 =0,25 mol glukose * (6 mol CO2 / 1 mol glukose) =1,5 mol CO2
5. Konverter mol af kuldioxid til gram:
* Molmasse CO2 =(12,01 g/mol) + (2 * 16,00 g/mol) =44,01 g/mol
* Gram CO2 =(1,5 mol) * (44,01 g/mol) =66,02 g
Derfor ville 66,02 gram kuldioxid blive produceret, hvis 45 gram glukose reagerede fuldstændigt med ilt.
Sidste artikelGør alle isotoper af et element fra de samme type ioner?
Næste artikelHvad er den sidste orbitaludfyldning af bromatom?
 Varme artikler
Varme artikler
-
 Sådan finder du molekylære lim til effektivt at målrette sygdommeNye strategier til små molekylære lim. Kredit:Eindhoven University of Technology Mange af de i øjeblikket tilgængelige lægemidler er ikke specifikke nok til effektivt at helbrede komplekse sygdomm
Sådan finder du molekylære lim til effektivt at målrette sygdommeNye strategier til små molekylære lim. Kredit:Eindhoven University of Technology Mange af de i øjeblikket tilgængelige lægemidler er ikke specifikke nok til effektivt at helbrede komplekse sygdomm -
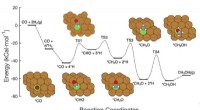 Machine learning framework ID'er mål til forbedring af katalysatorerDenne grafik viser syvtrins reaktionsvejen for CO-hydrogenering til methanol over kobberbaserede katalysatorer, inklusive reaktanterne på hvert trin, skematiske atomarrangementer af mellemprodukterne
Machine learning framework ID'er mål til forbedring af katalysatorerDenne grafik viser syvtrins reaktionsvejen for CO-hydrogenering til methanol over kobberbaserede katalysatorer, inklusive reaktanterne på hvert trin, skematiske atomarrangementer af mellemprodukterne -
 Ny metode til at fremme biofilmdannelse og øge effektiviteten af biokatalyseForskerne screenede syntetiske polymerer for deres evne til at inducere biofilmdannelse i en stamme af E. coli (MC4100), som er kendt for at være dårlig til at danne biofilm. De overvågede også biomas
Ny metode til at fremme biofilmdannelse og øge effektiviteten af biokatalyseForskerne screenede syntetiske polymerer for deres evne til at inducere biofilmdannelse i en stamme af E. coli (MC4100), som er kendt for at være dårlig til at danne biofilm. De overvågede også biomas -
 Forskere skaber kærlighedsmolekyle med færre komplikationerKredit:University of Queensland En ny og forbedret version af kærlighedshormonet oxytocin er blevet udviklet af University of Queensland forskere. Teamet fra UQs Institute for Molecular Bioscienc
Forskere skaber kærlighedsmolekyle med færre komplikationerKredit:University of Queensland En ny og forbedret version af kærlighedshormonet oxytocin er blevet udviklet af University of Queensland forskere. Teamet fra UQs Institute for Molecular Bioscienc
- Hvordan er udseendet af en solformørkelse, og hvordan ser det ud, når det ses fra Jorden?
- Hvad er processen med forstørrelse af mikroskop?
- Hvilken type potentiel energi har en klippe, der ligger på kanten, klippen?
- Hvordan masseproducerer robotter i cellestørrelse
- Den sydlige halvkugles vestlige vinde vil sandsynligvis intensivere, når klimaet bliver varmere
- Klynger 20 år med at studere Jordens magnetosfære


