Hvad er forskellen mellem kobbernitrat og nitrit?
* kobbernitrat har formlen cu (no₃) ₂ . Den indeholder nitration (ingen₃⁻) .
* kobbernitrit har formlen cu (no₂) ₂ . Den indeholder nitrition (ingen₂⁻) .
Her er en oversigt over de vigtigste forskelle:
| Funktion | Kobbernitrat (Cu (no₃) ₂) | Kobbernitrit (Cu (no₂) ₂) |
| ---------------- | --------------------------------- | ------------------------------------------------
| anion | Nitrat (ingen₃⁻) | Nitrit (no₂⁻) |
| Oxidationstilstand af nitrogen | +5 | +3 |
| stabilitet | Mere stabil | Mindre stabil |
| udseende | Blå krystaller | Grønblå krystaller |
| bruger | Oxidisator, gødning | Mindre almindelige anvendelser, men bruges i nogle organiske reaktioner |
Kortfattet:
* Den største forskel ligger i antallet af iltatomer I anionen. Nitrat har tre iltatomer, mens nitrit har to.
* Denne forskel i iltatomer fører til en forskel i oxidationstilstand af nitrogenatomet (+5 i nitrat, +3 i nitrit).
* Denne forskel i oxidationstilstand påvirker stabilitet af forbindelserne (nitrat er mere stabil).
Det er vigtigt at bemærke, at både kobbernitrat og kobbernitrit er stærke oxidatorer og skal håndteres med omhu.
Sidste artikelNår vandmolekyler holder sig til genstande kaldes?
Næste artikelHvad er de metaller, der er anført på periodisk tabel?
 Varme artikler
Varme artikler
-
 Forskere udvikler ny teknologi til udvinding af ikke-jernholdige og ædle metallerKredit:Ural Federal University Forskere ved Ruslands Ural Federal University (UrFU) arbejder på at løse problemet med at udvinde ikke-jernholdige og ædle metaller, som findes i malme, der er svære
Forskere udvikler ny teknologi til udvinding af ikke-jernholdige og ædle metallerKredit:Ural Federal University Forskere ved Ruslands Ural Federal University (UrFU) arbejder på at løse problemet med at udvinde ikke-jernholdige og ædle metaller, som findes i malme, der er svære -
 Gør renere, grønnere plast fra affaldsfiskdeleBrug af fiskeolie, forskere har lavet et polyurethan-lignende materiale. Kredit:Mikhailey Wheeler polyurethaner, en type plastik, er næsten overalt - i sko, tøj, køleskabe og byggematerialer. Men
Gør renere, grønnere plast fra affaldsfiskdeleBrug af fiskeolie, forskere har lavet et polyurethan-lignende materiale. Kredit:Mikhailey Wheeler polyurethaner, en type plastik, er næsten overalt - i sko, tøj, køleskabe og byggematerialer. Men -
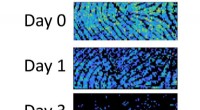 Rester i fingeraftryk indeholder spor af deres alderNiveauer af umættet triacylglycerol falder i fingeraftryk fra et individ fra dag 0 (øverst) til dag 1 (midten) og dag 3 (nederst). Kredit:Tilpasset fra Analytisk kemi 2020, DOI:10.1021/acs.analchem.
Rester i fingeraftryk indeholder spor af deres alderNiveauer af umættet triacylglycerol falder i fingeraftryk fra et individ fra dag 0 (øverst) til dag 1 (midten) og dag 3 (nederst). Kredit:Tilpasset fra Analytisk kemi 2020, DOI:10.1021/acs.analchem. -
 Forskere 3D-printer den første højtydende nanostrukturerede legering, der er både ultrastærk og …UMass Amherst Ph.D. studerende Jie Ren holder en miniature heatsink-ventilator, en af de 3D-printede højentropi legeringskomponenter lavet i Wen Chens laboratorium. Mikrostrukturens atomare omarrang
Forskere 3D-printer den første højtydende nanostrukturerede legering, der er både ultrastærk og …UMass Amherst Ph.D. studerende Jie Ren holder en miniature heatsink-ventilator, en af de 3D-printede højentropi legeringskomponenter lavet i Wen Chens laboratorium. Mikrostrukturens atomare omarrang
- Hvordan kan en kemisk reaktion afgøre, om der er dannet nyt stof?
- Hvad er årsagen til genotype og fænotype?
- Hvor ligger jorden ved Mælkevejen?
- Hvad fandt Big Data, da den analyserede 150 års britisk historie?
- Hvorfor er planeters bane forskellige?
- En liberal kultur i politiet er noget, der er værd at kæmpe for


