Hvad er ingredienserne til forbrænding?
1. brændstof: Dette er det stof, der brænder, hvilket giver energikilden til reaktionen. Almindelige eksempler inkluderer træ, papir, benzin, naturgas og propan.
2. oxidisator: Dette er det stof, der reagerer med brændstoffet, normalt ilt. Oxygen er den mest almindelige oxidation, men andre findes, såsom klor og fluor.
3. varme (tændingskilde): Dette giver den oprindelige energi, der er nødvendig for at starte den kemiske reaktion. Varmekilden kan være en gnist, flamme eller endda friktion.
Forbrændingsreaktionen:
Forbrændingsreaktionen er en kemisk proces, hvor brændstoffet reagerer med oxidatoren og frigiver varme og lys. Denne reaktion er typisk eksoterm, hvilket betyder, at den frigiver energi.
her er en simpel forklaring:
Forestil dig en brand. Træet (brændstof) reagerer med ilt i luften (oxidation). En gnist (varme) starter reaktionen, og ilden brænder og frigiver varme og lys.
Vigtig note: For at forbrænding skal forekomme, skal alle tre ingredienser være til stede i de korrekte proportioner. For eksempel starter en brand ikke, hvis der ikke er brændstof eller intet ilt.
 Varme artikler
Varme artikler
-
 Ultrasmå hule legeringsnanopartikler til synergistisk hydrogenudviklingskatalyseHER-polarisationskurverne for hule PtNiCu nanopartikler, kommerciel Pt/C, hule PtCoCu nanopartikler, hule PtCu nanopartikler og Cu nanopartikler i 1,0 M KOH vandig opløsning ved en scanningshastighed
Ultrasmå hule legeringsnanopartikler til synergistisk hydrogenudviklingskatalyseHER-polarisationskurverne for hule PtNiCu nanopartikler, kommerciel Pt/C, hule PtCoCu nanopartikler, hule PtCu nanopartikler og Cu nanopartikler i 1,0 M KOH vandig opløsning ved en scanningshastighed -
 Hvordan biologiens hårdest arbejdende pigmenter og MOF'er måske bare redder klimaetIllustration af den brede vifte af elektrokatalytiske og fotokatalytiske processer og anvendelser for porphyrin-rammematerialer. Kredit:Nano Research Energy , Tsinghua University Press Nogle af de
Hvordan biologiens hårdest arbejdende pigmenter og MOF'er måske bare redder klimaetIllustration af den brede vifte af elektrokatalytiske og fotokatalytiske processer og anvendelser for porphyrin-rammematerialer. Kredit:Nano Research Energy , Tsinghua University Press Nogle af de -
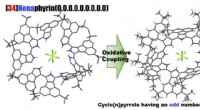 Syntese af en nær-infrarød lysabsorberende makrocyklisk aromatisk forbindelseSelektiv syntese af Cyclo [9] pyrroler Baseret på en oxidativ kobling. Kredit:Tetsuo Okujima, Ehime Universitet Profs. Okujima og Uno ved Ehime University, i samarbejde med prof. Kobayashi ved Shi
Syntese af en nær-infrarød lysabsorberende makrocyklisk aromatisk forbindelseSelektiv syntese af Cyclo [9] pyrroler Baseret på en oxidativ kobling. Kredit:Tetsuo Okujima, Ehime Universitet Profs. Okujima og Uno ved Ehime University, i samarbejde med prof. Kobayashi ved Shi -
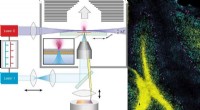 Innovativ metode giver unik indsigt i strukturen af celler og vævTil venstre:hvordan t-MALDI-2-MS billeddannelsesmetoden fungerer. Til højre:et eksempel, hvor den komplekse struktur af en mus cerebellum vises ved hjælp af overlejring af tre ionsignaler. Kredit:Natu
Innovativ metode giver unik indsigt i strukturen af celler og vævTil venstre:hvordan t-MALDI-2-MS billeddannelsesmetoden fungerer. Til højre:et eksempel, hvor den komplekse struktur af en mus cerebellum vises ved hjælp af overlejring af tre ionsignaler. Kredit:Natu
- Hvilke lyskilder kan du bruge med et dissekeringsmikroskop?
- Elizabeth I identificeret som forfatter til Tacitus-oversættelsen
- I mangel af luftfriktion er en horisontal komponent en hastighedsændring, da projektilbevægelser e…
- Første intensive målinger af lavvandede cumulusskyer over Indre Mongoliets græsland
- Hvem deler lignende erfaringer med klimaændringer i en 1,5 C-verden og videre?
- Tesco Bank idømt en bøde af den britiske regulator for hacking


