Hvorfor er brom og jod meget tættere end fluorklor?
* atomstørrelse og masse: Når du bevæger dig ned ad halogengruppen (gruppe 17) på den periodiske tabel, bliver atomerne større. Dette skyldes tilsætning af elektronskaller. Større atomer har også flere protoner og neutroner, hvilket resulterer i en større atommasse.
* Intermolekylære kræfter: Mens alle halogener har London-spredningskræfter, udviser brom og jod også stærkere van der Waals-kræfter (specifikt dipol-dipol-interaktioner) på grund af deres større størrelse og større elektronskypolariserbarhed. Disse stærkere intermolekylære kræfter holder molekylerne tættere sammen, hvilket bidrager til deres højere densitet.
* Materiale ved stuetemperatur: Fluor og klor er gasser ved stuetemperatur, mens brom er en væske, og jod er et fast stof. Denne forskel i fysisk tilstand afspejler direkte styrken af deres intermolekylære kræfter. Gasser har den laveste tæthed, efterfulgt af væsker og derefter faste stoffer.
Kortfattet: Den øgede atomstørrelse og masse sammen med stærkere intermolekylære kræfter fører til en højere densitet for brom og jod sammenlignet med fluor og klor.
 Varme artikler
Varme artikler
-
 Potentielle anti-aldringskomponenter af Moringa oleifera bladNetværksdiagram over multikomponent- og multi-target-interaktioner af Moringa oleifera-blade. Kredit:WBG Moringa oleifera Lam., også kendt som Miracle Tree, primært afledt fra Indien, er nu vidt ud
Potentielle anti-aldringskomponenter af Moringa oleifera bladNetværksdiagram over multikomponent- og multi-target-interaktioner af Moringa oleifera-blade. Kredit:WBG Moringa oleifera Lam., også kendt som Miracle Tree, primært afledt fra Indien, er nu vidt ud -
 Fra identifikation til et kemisk fingeraftryk for sprængstoffer i retsmedicinsk forskningCobra fyrværkeri. Kredit:Karlijn Bezemer Politiet støder ofte på sprængstoffer i deres retsmedicinske efterforskninger relateret til kriminelle og terroraktiviteter. Kemisk analyse af sprængstoffe
Fra identifikation til et kemisk fingeraftryk for sprængstoffer i retsmedicinsk forskningCobra fyrværkeri. Kredit:Karlijn Bezemer Politiet støder ofte på sprængstoffer i deres retsmedicinske efterforskninger relateret til kriminelle og terroraktiviteter. Kemisk analyse af sprængstoffe -
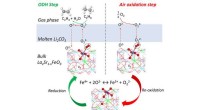 Katalysator åbner døren til mere effektiv, miljøvenlig produktion af ethylenReaktionsveje til oxidativ dehydrogenering af ethan lettet af den smeltede carbonatskal modificerede perovskit redox katalysator. Kredit:Fanxing Li, NC State University Et forskerhold ledet af Nor
Katalysator åbner døren til mere effektiv, miljøvenlig produktion af ethylenReaktionsveje til oxidativ dehydrogenering af ethan lettet af den smeltede carbonatskal modificerede perovskit redox katalysator. Kredit:Fanxing Li, NC State University Et forskerhold ledet af Nor -
 Når flere knogledannende celler er lig med mindre knogleForskere ved UConn Health har vist, hvordan et muteret gen forårsager overskydende knogleresorption i en sjælden knoglesygdom kendt som Lehmans syndrom. Deres forskning er forsideartiklen i 7. septemb
Når flere knogledannende celler er lig med mindre knogleForskere ved UConn Health har vist, hvordan et muteret gen forårsager overskydende knogleresorption i en sjælden knoglesygdom kendt som Lehmans syndrom. Deres forskning er forsideartiklen i 7. septemb
- Hvad er dominerende og recessiv allel?
- Gode vibrationer er ikke længere nødvendige for højttalere, da forskning tilskynder grafen til …
- Hvad er den kemiske formel for ammoniumchlorat?
- Forskere udvikler kompakte, intens XUV -laser
- Hvad bruger kroppen først til energi?
- Hvad er den slags stjerner i henhold til deres størrelse?


