Hvorfor ændres koncentrationen af tin -sulfatopløsning ikke under elektrolyse?
elektrolyse af tin sulfatopløsning
Tin sulfat (SNSO₄) er et salt, der adskiller sig i opløsning i tinioner (Sn²⁺) og sulfationer (SO₄²⁻). Når en elektrisk strøm føres gennem denne opløsning, forekommer følgende reaktioner:
* ved katoden (negativ elektrode): Tinioner (sn²⁺) får elektroner og reduceres til metallisk tin (SN):
Sn²⁺ + 2e⁻ → Sn
* ved anoden (positiv elektrode): Vandmolekyler oxideres til iltgas og brintioner:
2H₂O → O₂ + 4H⁺ + 4E⁻
Koncentrationsændringer
* tinioner (sn²⁺): Koncentrationen af tinioner falder, da de reduceres til metallisk tin ved katoden. Dette fører til et fald i koncentrationen af tin sulfat i opløsningen.
* sulfationer (so₄²⁻): Koncentrationen af sulfationer forbliver uændrede, fordi de ikke er involveret i elektrode -reaktionerne.
* hydrogenioner (H⁺): Koncentrationen af brintioner øges ved anoden på grund af oxidation af vand. Dette kan lidt påvirke pH i opløsningen, hvilket gør den mere surt.
hvorfor det kan virke som om koncentrationen ikke ændrer
* Begrænset elektrolyse: Hvis elektrolysen udføres i en kort varighed, kan ændringerne i koncentration være for små til at være mærkbare.
* overskydende tin sulfat: Hvis opløsningen indeholder et stort overskud af tin -sulfat, ændrer reduktionen af en lille mængde tinioner muligvis ikke signifikant den samlede koncentration.
* reversible reaktioner: I nogle tilfælde reagerer tin, der er deponeret ved katoden, med sulfationerne i opløsningen, hvilket fører til en midlertidig stigning i koncentrationen af tin -sulfat. Dette er dog en kompleks proces og afhænger af forskellige faktorer.
Kortfattet: Mens koncentrationen af sulfationer muligvis forbliver relativt konstant, falder koncentrationen af tin sulfat Under elektrolyse på grund af reduktion af tinioner ved katoden.
 Varme artikler
Varme artikler
-
 Jernbaserede solceller på vej til at blive mere effektiveKredit:CC0 Public Domain En international undersøgelse ledet fra Lunds Universitet i Sverige viser, at 30 procent af energien i en bestemt type lysabsorberende jernmolekyle forsvinder på en hidtil
Jernbaserede solceller på vej til at blive mere effektiveKredit:CC0 Public Domain En international undersøgelse ledet fra Lunds Universitet i Sverige viser, at 30 procent af energien i en bestemt type lysabsorberende jernmolekyle forsvinder på en hidtil -
 Retskemiske laserteknik skelner mellem menneske- og dyreblodIgor Lednev har en prototype af en scanner, der kan bruges af retshåndhævere til at analysere biologiske pletter på gerningssteder. Kredit:University at Albany Ny forskning udgivet af retskemiker
Retskemiske laserteknik skelner mellem menneske- og dyreblodIgor Lednev har en prototype af en scanner, der kan bruges af retshåndhævere til at analysere biologiske pletter på gerningssteder. Kredit:University at Albany Ny forskning udgivet af retskemiker -
 Omgivet af potentiale:Ny videnskab i omdannelse af biomasseTEM-billede af Ce-P-Pd elementærkort. Kredit:Igor Slowing I hver plante - fra træer til afgrøder - findes der et stof, der udgør dens træ eller stængler, fiber, og cellevægge. Dette stof er en kom
Omgivet af potentiale:Ny videnskab i omdannelse af biomasseTEM-billede af Ce-P-Pd elementærkort. Kredit:Igor Slowing I hver plante - fra træer til afgrøder - findes der et stof, der udgør dens træ eller stængler, fiber, og cellevægge. Dette stof er en kom -
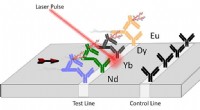 Ny teknologi til patogendetektion drevet af laserePurdue innovatører har udviklet et lanthanid-baseret assay kombineret med en laser, der kan bruges til at påvise toksiner og patogene E. coli i fødevareprøver, vand og en række industrielle materialer
Ny teknologi til patogendetektion drevet af laserePurdue innovatører har udviklet et lanthanid-baseret assay kombineret med en laser, der kan bruges til at påvise toksiner og patogene E. coli i fødevareprøver, vand og en række industrielle materialer
- Hvad er de halve ligninger til rensning af kobber?
- Denne type energiformer på grund af tilfældige bevægelsespartikler?
- Hvad er atomantallet af fosfat?
- Forskere validerer, at UV-lys bruges til at forbedre halvledere
- Hvor meget energi tager det at varme vand med grader c?
- Hvilke elementer er metaller?


