Hvad er de halve ligninger til rensning af kobber?
processen
Kobberraffinering via elektrolyse er en proces, der bruger en elektrisk strøm til at adskille urenheder fra urent kobber (ofte kaldet blister kobber). Her er en forenklet oversigt:
1. elektrolyt: Processen bruger en elektrolytopløsning indeholdende kobber (II) sulfat (cuso₄) og svovlsyre (H₂so₄).
2. anode: Det uren kobber bruges som anode (positiv elektrode).
3. katode: Et tyndt ark med rent kobber fungerer som katoden (negativ elektrode).
halvreaktioner
* oxidation ved anoden (uren kobber):
- Cu (s) → cu²⁺ (aq) + 2e⁻
Denne halvreaktion repræsenterer oxidation af kobberatomer ved anoden. Kobberatomerne mister elektroner til dannelse af kobber (II) -ioner, der opløses i elektrolytten.
* reduktion ved katoden (rent kobber):
- cu²⁺ (aq) + 2e⁻ → cu (s)
Denne halvreaktion repræsenterer reduktionen af kobber (II) -ioner ved katoden. Kobber (II) ioner fra elektrolytten får elektroner og afsæt som rent kobber på katoden.
urenheder
* Mere reaktive metaller: Metaller som zink (Zn) og jern (Fe), der er mere reaktive end kobber, vil også blive oxideret ved anoden. De vil danne deres respektive ioner (Zn²⁺ og Fe²⁺) og forblive i elektrolytopløsningen.
* mindre reaktive metaller: Metaller som sølv (AG) og guld (AU), der er mindre reaktive end kobber, oxideres ikke. De falder til bunden af anoden som en værdifuld "anodemudder."
samlet reaktion
Den samlede reaktion kan skrives som summen af de to halvreaktioner:
Cu (uren) → Cu (ren)
Vigtig note: Dette er en forenklet forklaring. Den faktiske proces kan involvere komplekse reaktioner og bivirkninger, og de specifikke betingelser for elektrolysen kan påvirke resultatet.
 Varme artikler
Varme artikler
-
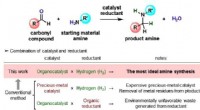 Nærmer sig en ideel aminosyresyntese ved hjælp af hydrogenFigur 1. Generelt skema for katalytisk reduktiv alkylering af aminer. Kredit:Osaka University Osaka Universitets forskere demonstrerede en reduktiv alkyleringsmetode til funktionalisering af subst
Nærmer sig en ideel aminosyresyntese ved hjælp af hydrogenFigur 1. Generelt skema for katalytisk reduktiv alkylering af aminer. Kredit:Osaka University Osaka Universitets forskere demonstrerede en reduktiv alkyleringsmetode til funktionalisering af subst -
 Opløsning af molekyleinformation i dynamisk lipidmembran med metaoverfladerMulti-resonante mid-IR nanoantenner udnyttes til at forbedre vibrationsabsorptionssignalerne forbundet med biomimetisk lipidmembrandannelse, polypeptid/membran interaktion, og vesikulær lastudløsning
Opløsning af molekyleinformation i dynamisk lipidmembran med metaoverfladerMulti-resonante mid-IR nanoantenner udnyttes til at forbedre vibrationsabsorptionssignalerne forbundet med biomimetisk lipidmembrandannelse, polypeptid/membran interaktion, og vesikulær lastudløsning -
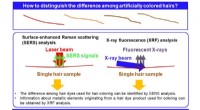 Inden for en hårsbredde – retsmedicinsk identifikation af enkeltfarvet hårstrå nu muligtEn oversigt over de analytiske teknikker, der er brugt i denne undersøgelse, som tilsammen gør det muligt at skelne mellem to enkeltstrå farvet hår. Kredit:Shinsuke Kunimura fra Tokyo University of Sc
Inden for en hårsbredde – retsmedicinsk identifikation af enkeltfarvet hårstrå nu muligtEn oversigt over de analytiske teknikker, der er brugt i denne undersøgelse, som tilsammen gør det muligt at skelne mellem to enkeltstrå farvet hår. Kredit:Shinsuke Kunimura fra Tokyo University of Sc -
 Ny brug af NMR kaster lys over elektropolymeriserede katalysatorer, der er nemme at fremstilleSEM-billeder (×30k) af PANI (a) og PASP (b) tynde film dyrket på GCEer. Kredit:American Institute of Physics I en verden af katalytiske reaktioner, polymerer skabt gennem elektropolymerisation t
Ny brug af NMR kaster lys over elektropolymeriserede katalysatorer, der er nemme at fremstilleSEM-billeder (×30k) af PANI (a) og PASP (b) tynde film dyrket på GCEer. Kredit:American Institute of Physics I en verden af katalytiske reaktioner, polymerer skabt gennem elektropolymerisation t


