Hvordan tegner du Lewis -strukturen til en acetation?
1. Tæl valenselektronerne:
* Carbon (C):4 Valenselektroner X 2 =8
* Hydrogen (H):1 valenselektron x 3 =3
* Oxygen (O):6 Valenselektroner x 2 =12
* Opladning (-1):+1
Samlede valenselektroner: 8 + 3 + 12 + 1 = 24
2. Tilslut atomerne:
* De to kulhydrater danner en enkelt binding.
* Hvert kul har tre hydrogenatomer fastgjort til det (methylgruppe).
* Et iltatom er dobbeltbundet til et kulstof.
* Det andet iltatom er enkeltbundet til det samme kulstof.
3. Distribuer de resterende elektroner:
* Start med at afslutte okteterne af de ydre iltatomer (den med dobbeltbindingen og den med den enkelte binding). Hver har brug for 6 flere elektroner.
* Det centrale kulstof med dobbeltbindingen har allerede en oktet.
* Det centrale kulstof med den enkelte binding har kun 6 elektroner. For at afslutte sin Octet har den brug for yderligere 2 elektroner. Du kan flytte et af de ensomme par fra det negativt ladede ilt for at danne en dobbeltbinding mellem kulstof og ilt.
4. Angiv gebyret:
* Da acetationen har en negativ ladning, skal du placere firkantede parenteser omkring strukturen og skrive -1 -ladningen uden for parenteserne.
Final Lewis -struktur:
`` `
H
|
H - C - C =O
| ||
H o⁻
|
H
[Ch₃coo] ⁻
`` `
Nøglepunkter:
* Dobbeltbindingen kan placeres på et af iltatomerne. Begge er ækvivalente resonansstrukturer.
* Den negative ladning delokaliseres mellem de to iltatomer.
* Lewis -strukturen hjælper os med at visualisere bindings- og elektronfordelingen i acetationen.
 Varme artikler
Varme artikler
-
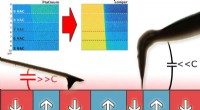 Forbedring af den piezoelektriske mikroskopi karakterisering af keramiske materialerFigur 1:Sidebillede af de to typer anvendte AFM-prober. Den til højre er en ultralang spids, som mindsker den elektrostatiske interaktion mellem udkrageren og prøven. Sammenlignet med standardspidsen,
Forbedring af den piezoelektriske mikroskopi karakterisering af keramiske materialerFigur 1:Sidebillede af de to typer anvendte AFM-prober. Den til højre er en ultralang spids, som mindsker den elektrostatiske interaktion mellem udkrageren og prøven. Sammenlignet med standardspidsen, -
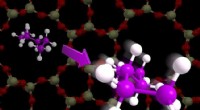 Forskere opdager, hvordan burmolekyler rasler og syngerHexan, et molekyle med seks carbonatomer, vil vælte, spin og vibrere mindre i et nanoporøst bur, men den kan stadig bevæge sig i to dimensioner. Kredit:Catalysis Center for Energy Innovation Et te
Forskere opdager, hvordan burmolekyler rasler og syngerHexan, et molekyle med seks carbonatomer, vil vælte, spin og vibrere mindre i et nanoporøst bur, men den kan stadig bevæge sig i to dimensioner. Kredit:Catalysis Center for Energy Innovation Et te -
 Forskere bygger mikroporøse MOF-fælder til at afbøde giftige gasserKredit:Oak Ridge National Laboratory Nitrogendioxid og svovldioxid (NO2 og SO2 ) er giftige gasser, der er skadelige for miljøet og menneskers sundhed. Når de kommer ind i atmosfæren, kan de rejse
Forskere bygger mikroporøse MOF-fælder til at afbøde giftige gasserKredit:Oak Ridge National Laboratory Nitrogendioxid og svovldioxid (NO2 og SO2 ) er giftige gasser, der er skadelige for miljøet og menneskers sundhed. Når de kommer ind i atmosfæren, kan de rejse -
 Gør bleer til klistermærker:Brug kemisk genbrug til at forhindre millioner af tons affaldKredit:Pixabay/CC0 Public Domain Hvert år, 3,5 millioner tons opblødte bleer ender på lossepladser. Det superabsorberende materiale inde i disse bleer består af en matrix af polymerer, der udvide
Gør bleer til klistermærker:Brug kemisk genbrug til at forhindre millioner af tons affaldKredit:Pixabay/CC0 Public Domain Hvert år, 3,5 millioner tons opblødte bleer ender på lossepladser. Det superabsorberende materiale inde i disse bleer består af en matrix af polymerer, der udvide
- Hvad sker der med potentiel energi, når afgifter flytter?
- Ny teknik afslører tabte pragt af Herculaneum-kunst
- Plastfantastiske eller naturbaserede legepladser:Hvilken er bedst for børns udvikling?
- Hvad er farverne på blysalte?
- Hvad er det største lag af jordoverfladen sammensat for det meste siliciumoxygenmagnesium og jern?
- Lithium-ion batteri Pros & Cons


