Hvis otte atomer af jern reagerer fuldstændigt med seks molekyler ilt, hvor mange enheder oxid dannes?
1. Skriv den afbalancerede kemiske ligning:
Reaktionen mellem jern (Fe) og ilt (O₂) producerer jernoxid (Fe₂o₃):
4 Fe + 3 O₂ → 2 Fe₂o₃
2. Bestem den begrænsende reaktant:
* jern (Fe): Vi har 8 atomer jern.
* ilt (O₂): Vi har 6 molekyler ilt.
Den afbalancerede ligning viser, at 4 mol jern reagerer med 3 mol ilt. For at finde ud af den begrænsende reaktant kan vi bruge molforholdet:
* jern: (8 Atoms Fe) / (4 atomer Fe pr. Mol) =2 mol Fe
* ilt: (6 molekyler O₂) / (3 molekyler O₂ pr. Mol) =2 mol O₂
Da både jern og ilt har det samme antal mol, kan vi enten bruge til at bestemme mængden af produkt.
3. Beregn mængden af produkt:
Den afbalancerede ligning viser, at 4 mol jern reagerer på producerer 2 mol jernoxid. Da vi har 2 mol jern, kan vi beregne:
(2 mol Fe) * (2 mol Fe₂o₃ / 4 mol Fe) = 1 mol Fe₂o₃
Svar:
En mol jernoxid (Fe₂o₃) vil blive dannet.
Sidste artikelHvad er elektronegativitetsforskellen mellem fluor og francium?
Næste artikelHvordan fjerner calciumhydroxid svovldioxid?
 Varme artikler
Varme artikler
-
 Bilag A og andre true crime-shows kan give anledning til misforståelser om retsmedicinsk videnskabKredit:Microgen/Shutterstock Retsmedicinsk videnskab er under angreb. En række nylige kollapsede retssager og annullerede domme, der var baseret på retsmedicinske beviser, har fået nogle eksperter
Bilag A og andre true crime-shows kan give anledning til misforståelser om retsmedicinsk videnskabKredit:Microgen/Shutterstock Retsmedicinsk videnskab er under angreb. En række nylige kollapsede retssager og annullerede domme, der var baseret på retsmedicinske beviser, har fået nogle eksperter -
 Organiske metalskeletter lavet til at fungere som væskerEn udfordring for holdet var at få en krystallinsk MOF til at opføre sig som en porøs væske. Holdet opdagede, hvordan man modificerer overfladen af relativt store MOF-nanopartikler med passende kemi
Organiske metalskeletter lavet til at fungere som væskerEn udfordring for holdet var at få en krystallinsk MOF til at opføre sig som en porøs væske. Holdet opdagede, hvordan man modificerer overfladen af relativt store MOF-nanopartikler med passende kemi -
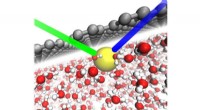 Den subtile rolle af overflader i ion-klæbrighedI vand (røde og hvide strukturer), den direkte interaktion mellem grafen (grå) og en thiocyanat (SCN‒) ion (gul) får ionen til at adsorbere til overfladen. De grønne og blå linjer repræsenterer indfal
Den subtile rolle af overflader i ion-klæbrighedI vand (røde og hvide strukturer), den direkte interaktion mellem grafen (grå) og en thiocyanat (SCN‒) ion (gul) får ionen til at adsorbere til overfladen. De grønne og blå linjer repræsenterer indfal -
 Li-ioner transporterer på tværs af elektrolytter og SEIKredit:CC0 Public Domain Li-ion-transportens kinetik på tværs af elektrolytten og SEI er sædvanligvis det hastighedsbestemmende trin i Li-plettering-stripningsprocessen. Før galvanisering på anode
Li-ioner transporterer på tværs af elektrolytter og SEIKredit:CC0 Public Domain Li-ion-transportens kinetik på tværs af elektrolytten og SEI er sædvanligvis det hastighedsbestemmende trin i Li-plettering-stripningsprocessen. Før galvanisering på anode
- Ligning, når propansyre reagerer med ethylamin?
- Hvad er der dannes 4 måder, hvorpå bjerge kan dannes?
- Hvad blokkerer enzymaktiviteten ved at binde til det aktive site af et enzym?
- Hvad er bølgelængden af en 25Hz sinusbølge?
- Hvor meget energi har en 445 nm lysbølge (hastigheden i vakuum er 3,00 108 ms og konstant 6,626 10-…
- Udvidelse af temperaturområdet for lithium-ion-batterier


