Hvad reagerer med fosfat?
uorganiske reaktioner:
* syrer: Phosphat reagerer med syrer til dannelse af fosforsyre (H₃po₄). For eksempel:
* Po₄³⁻ + 3H⁺ → H₃po₄
* metalioner: Fosfat danner uopløselige salte med mange metalioner, som calcium (Ca²⁺) og magnesium (Mg²⁺), hvilket fører til udfældning af disse ioner fra opløsning. Dette er vigtigt i biologiske systemer, for eksempel i knogledannelse.
* 3Ca²⁺ + 2po₄³⁻ → Ca₃ (PO₄) ₂ (calciumphosphat)
* Hydrogenioner: Fosfat kan fungere som en puffer, der reagerer med hydrogenioner for at danne dihydrogenphosphat (H₂po₄⁻) og monohydrogenphosphat (HPO₄²⁻), hvilket således modstår ændringer i PH.
* Po₄³⁻ + H⁺ → HPO₄²⁻
* HPO₄²⁻ + H⁺ → H₂po₄⁻
organiske reaktioner:
* Alkoholer: Fosfat kan reagere med alkoholer for at danne estere. Dette er vigtigt i biologiske systemer, for eksempel i dannelsen af phospholipider.
* PO₄³⁻ + ROH → RO-PO₃²⁻ + H₂O
* sukker: Fosfat kan reagere med sukker til dannelse af sukkerphosphater, som er vigtige mellemprodukter i metaboliske veje.
* PO₄³⁻ + C₆H₁₂O₆ → C₆H₁₁O₆-PO₄²⁻ + H₂O (Glucose + Phosphate → Glucose-6-phosphat)
* Proteiner: Fosfat kan binde til proteiner og ændre deres struktur og aktivitet. Denne proces, kaldet phosphorylering, er afgørende for at regulere mange cellulære processer.
Andre reaktioner:
* Hydrolyse: Fosfat kan hydrolyseres til dannelse af ortophosphat (H₃po₄), som derefter hydrolyseres yderligere til dannelse af dihydrogenphosphat (H₂po₄⁻), monohydrogenphosphat (HPO₄²⁻) og til sidst phosphat (Po₄³⁻).
* redoxreaktioner: Fosfat kan deltage i redoxreaktioner og fungere som et oxiderende eller reduktionsmiddel.
Den specifikke reaktion af fosfat afhænger af reaktionsbetingelserne, såsom pH, temperatur og tilstedeværelsen af andre reaktanter.
Det er vigtigt at bemærke, at dette ikke er en udtømmende liste, og fosfat kan deltage i mange andre reaktioner. Reaktionerne af fosfat er grundlæggende for mange biologiske og industrielle processer.
 Varme artikler
Varme artikler
-
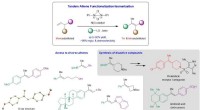 Stereoselektiv alkensyntese med ikke-ædel nikkelkatalyseSkematisk, der viser udviklingen af et nyt Ni-katalyseret system, der konverterer billige og let tilgængelige monosubstituerede olefiner til højværdi tri- og tetrasubstituerede analoger, og dets anv
Stereoselektiv alkensyntese med ikke-ædel nikkelkatalyseSkematisk, der viser udviklingen af et nyt Ni-katalyseret system, der konverterer billige og let tilgængelige monosubstituerede olefiner til højværdi tri- og tetrasubstituerede analoger, og dets anv -
 Afvisende forskning:Søværnet udvikler skibsbelægninger for at reducere brændstof, energiomkostni…Mathew Boban, en kandidatstuderende forskningsassistent ved University of Michigan, hælder hexadecanolie på et objektglas dækket med en omnifobisk belægning. De oliebaserede, meget viskøs olie glider
Afvisende forskning:Søværnet udvikler skibsbelægninger for at reducere brændstof, energiomkostni…Mathew Boban, en kandidatstuderende forskningsassistent ved University of Michigan, hælder hexadecanolie på et objektglas dækket med en omnifobisk belægning. De oliebaserede, meget viskøs olie glider -
 Udvikling af et værktøj til strømlinet molekylvægtsanalyseKredit:Unsplash/CC0 Public Domain Ny verdensførste forskning ledet af Griffith University har strømlinet processen med at identificere strukturen og molekylvægten af forbindelser, som kunne have
Udvikling af et værktøj til strømlinet molekylvægtsanalyseKredit:Unsplash/CC0 Public Domain Ny verdensførste forskning ledet af Griffith University har strømlinet processen med at identificere strukturen og molekylvægten af forbindelser, som kunne have -
 SpaceMat:Graphenes svar på genbrug af dækgummi, der lanceres på markedetKredit:University of Manchester En nystartet virksomhed i Greater Manchester har lanceret det første af en række produkter, der har til formål at reducere spild fra køretøjsdæk, støttet af Graphen
SpaceMat:Graphenes svar på genbrug af dækgummi, der lanceres på markedetKredit:University of Manchester En nystartet virksomhed i Greater Manchester har lanceret det første af en række produkter, der har til formål at reducere spild fra køretøjsdæk, støttet af Graphen
- Hvilke planeter har folk gået videre?
- Hvordan har videnskabsmand været i stand til at bestemme sammensætningen af jordens lag?
- Hvordan lød Big Bang?
- Fra biler til Mars:Hvad der er godt for F1, er godt for livet i hele universet
- En 65 kg svømmer hopper fra et 10 m tårn Find hastigheden ved at ramme vand?
- Maskinlæring låser op for mysterier i kvantefysikken


