Hvad sker der, når et bromatom får Electorn?
* Bromes elektronkonfiguration: Brom har 35 elektroner. Dens elektronkonfiguration er [AR] 3D¹⁰ 4S² 4P⁵. Det har kun brug for endnu en elektron for at fylde sin yderste P orbital, hvilket gør det mere stabilt.
* At få en elektron: Ved at få en elektron opnår brom en fuld oktet i sin yderste skal. Dette gør ionen meget mere stabil end det neutrale atom.
* Dannelse af bromidionen: Den opnåede elektron fylder 4p orbital, hvilket giver bromidionen den samme elektronkonfiguration som den ædle gas krypton.
Her er et resumé:
* bromatom (BR): Neutral, 35 elektroner, elektronkonfiguration [AR] 3D¹⁰ 4S² 4P⁵
* bromidion (br⁻): Negativt ladede, 36 elektroner, elektronkonfiguration [AR] 3D¹⁰ 4S² 4P⁶ (samme som Krypton)
Bromidionen er nu mere stabil og mindre tilbøjelig til at reagere yderligere. Dette er en almindelig forekomst i kemi, hvor atomer får eller mister elektroner for at opnå en mere stabil tilstand.
 Varme artikler
Varme artikler
-
 Kompakt fiberoptisk apparat skinner lys på åndedrætsanalyse i realtidKredit:Tohoku University Ved hjælp af hulkerne optisk fiber som en følsom gascelle, forskere i Japan har udviklet en relativt enkel og overkommelig sensor til overvågning af biomarkører i menneske
Kompakt fiberoptisk apparat skinner lys på åndedrætsanalyse i realtidKredit:Tohoku University Ved hjælp af hulkerne optisk fiber som en følsom gascelle, forskere i Japan har udviklet en relativt enkel og overkommelig sensor til overvågning af biomarkører i menneske -
 At lave masker ved hjælp af Turings matematiske modeller resulterer i effektive vandfiltreElektronmikrografer af PA-membraner af Turing-typen. (A) Lav forstørrelse SEM-billeder af de to membranoverflader. (B) SEM-billeder med høj forstørrelse af de to forskellige strukturer. (C og D) Proji
At lave masker ved hjælp af Turings matematiske modeller resulterer i effektive vandfiltreElektronmikrografer af PA-membraner af Turing-typen. (A) Lav forstørrelse SEM-billeder af de to membranoverflader. (B) SEM-billeder med høj forstørrelse af de to forskellige strukturer. (C og D) Proji -
 Nye hydrogeler visner, mens stamceller blomstrer til vævsreparationSkematisk viser MAP hydrogel mikroperler (blå) fyldt med stamceller (grå). Kredit:Texas A&M Engineering Babybleer, kontaktlinser og gelatinedessert. Selvom det tilsyneladende ikke er relateret, di
Nye hydrogeler visner, mens stamceller blomstrer til vævsreparationSkematisk viser MAP hydrogel mikroperler (blå) fyldt med stamceller (grå). Kredit:Texas A&M Engineering Babybleer, kontaktlinser og gelatinedessert. Selvom det tilsyneladende ikke er relateret, di -
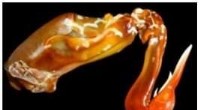 Mantis-rejeklubbens mangefacetterede design er inspirerende avancerede kompositmaterialer til fly, f…Et tværsnit af mantis-rejeklubben viser den stribede region, der var karakteriseret af UCR-forskere. Denne region består af en unik struktur, der vikler sig rundt om køllen for at beskytte den mod sel
Mantis-rejeklubbens mangefacetterede design er inspirerende avancerede kompositmaterialer til fly, f…Et tværsnit af mantis-rejeklubben viser den stribede region, der var karakteriseret af UCR-forskere. Denne region består af en unik struktur, der vikler sig rundt om køllen for at beskytte den mod sel
- Kan et jordskælv forårsage en kaskade af flere?
- At konfrontere stressede situationer kræver tidsenergi?
- Hvad er massen på 0,05 mol ilt?
- Hvad er astrolabel?
- Folketællingsdata kan udjævne vilkårene for små virksomheder
- To faciliteter slår sig sammen om fremskridt inden for strukturbiologi med røntgen-frielektronlase…


