Hvorfor finder ingen reaktion sted mellem metan og klor ved stuetemperatur?
* obligationsstyrke: Bindingerne i metan og klor er relativt stærke. For at indlede en reaktion skal disse bindinger brydes, hvilket kræver energi.
* endotermisk natur: Det indledende trin i reaktionen involverer brud på klorbindinger, som er en endotermisk proces (kræver energiindgang).
* Kollisionsteori: For at en reaktion kan forekomme, skal molekyler kollidere med tilstrækkelig energi til at bryde eksisterende bindinger og danne nye. Ved stuetemperatur er kollisionerne mellem metan- og klormolekyler ikke energiske nok til at overvinde aktiveringsenergibarrieren.
hvordan reaktionen opstår:
* Lysenergi: Reaktionen mellem metan og klor initieres af UV -lys (Fotokemisk reaktion). Lyset giver den nødvendige energi til at bryde klorbindingen og skabe stærkt reaktive klorradikaler.
* kædereaktion: Chlorradikalerne reagerer derefter med methan og danner en methylradikal og brintchlorid. Disse radikaler udbreder derefter en kædereaktion, hvilket fører til dannelse af chlormethan og andre klorerede produkter.
Sammendrag:
Mens metan og klor kan reagere, gør de det ikke ved stuetemperatur, fordi reaktionen har brug for en betydelig mængde aktiveringsenergi. UV -lys giver den nødvendige energi til at starte reaktionen, hvilket fører til en kædereaktion, der producerer chlorerede produkter.
 Varme artikler
Varme artikler
-
 Ildfluer kaster lys over mitokondriernes funktionKredit:CC0 Public Domain Små fabrikker flyder inde i vores celler og giver dem næsten al den energi, de har brug for:mitokondrierne. Deres effektivitet falder, når vi bliver ældre, men også når vi
Ildfluer kaster lys over mitokondriernes funktionKredit:CC0 Public Domain Små fabrikker flyder inde i vores celler og giver dem næsten al den energi, de har brug for:mitokondrierne. Deres effektivitet falder, når vi bliver ældre, men også når vi -
 Se, hvordan en kovalent polymer udvikler sig ved hjælp af et scanningstunnelmikroskopUorden-til-orden overgang. Kredit:Nature (2022). DOI:10.1038/s41586-022-04409-6 Et team af forskere fra KU Leuven, University of Aveiro, OLYMAT, University of the Basque Country UPV/EHU og Ikerbasq
Se, hvordan en kovalent polymer udvikler sig ved hjælp af et scanningstunnelmikroskopUorden-til-orden overgang. Kredit:Nature (2022). DOI:10.1038/s41586-022-04409-6 Et team af forskere fra KU Leuven, University of Aveiro, OLYMAT, University of the Basque Country UPV/EHU og Ikerbasq -
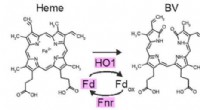 Effektiv syntese af et fotosyntetisk pigment i pattedyrceller til optogenetikFire enzymer, der kræves til PCB-syntese fra hæm (HO1, PCyA, Fd, Fnr). Forskergruppen lykkedes med at syntetisere PCB i dyreceller ved at introducere disse fire enzymgener. Kredit:NIBB Den optogen
Effektiv syntese af et fotosyntetisk pigment i pattedyrceller til optogenetikFire enzymer, der kræves til PCB-syntese fra hæm (HO1, PCyA, Fd, Fnr). Forskergruppen lykkedes med at syntetisere PCB i dyreceller ved at introducere disse fire enzymgener. Kredit:NIBB Den optogen -
 Fremtidens MOF'er:Konvertering af krystallinske metal-organiske rammer til glas eller væskeKrystallinske MOFer bliver nu omdannet til glas/flydende tilstande, åbne nye applikationer. Kredit:Mindy Takamiya Metal-organiske rammer (MOFer) er porøse, krystallinske materialer, der kan fange
Fremtidens MOF'er:Konvertering af krystallinske metal-organiske rammer til glas eller væskeKrystallinske MOFer bliver nu omdannet til glas/flydende tilstande, åbne nye applikationer. Kredit:Mindy Takamiya Metal-organiske rammer (MOFer) er porøse, krystallinske materialer, der kan fange
- Hvad er det sammensatte navn på Cucl3?
- Mexicos energireform kan øge den socio-miljømæssige konflikt
- Hvilken attraktiv kraft mellem to objekter, der afhænger af masserne af og afstand dem, er?
- Hvilke to plader kolliderede for at danne mt.etna?
- Forskere, der arbejder på at få robotter på størrelse med molekyler til at sværme sammen for at…
- Tre måder for organismer at få energi på?


