Hvad vil reaktionen af brintperoxid med estere?
Her er hvorfor:
* estere er relativt stabile: Estere er relativt ureaktive forbindelser på grund af den stærke carbon-ilt dobbeltbinding i carbonylgruppen.
* Hydrogenperoxid er et svagt oxidationsmiddel: Mens H₂O₂ kan fungere som et oxidationsmiddel, er det ikke stærkt nok til at bryde de stabile bindinger inden for estermolekylet.
mulige reaktioner under specifikke forhold:
* Hydrolyse: Hvis du skulle tilsætte en stærk syre eller base til blandingen, kan du potentielt hydrolysere esteren til at danne en carboxylsyre og en alkohol. Dette er imidlertid en reaktion af esteren med syren/basen, ikke direkte med hydrogenperoxid.
* peroxiddannelse (sjælden): Under ekstremt specifikke omstændigheder med tilstedeværelsen af en passende katalysator og under meget kontrollerede forhold kan du muligvis se dannelsen af et peroxidderivat af esteren. Dette er dog meget usandsynligt og ikke en typisk reaktion.
Kortfattet:
Reaktionen mellem hydrogenperoxid og estere anses generelt for at være ubetydelig. Stabiliteten af esteren og den svage oxidationsevne af brintperoxid forhindrer betydelige reaktioner i at forekomme.
Sidste artikelReagerer tin med citronsyre?
Næste artikelHvad hedder forbindelsen med formel PL3?
 Varme artikler
Varme artikler
-
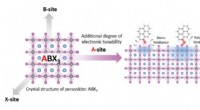 Ny måde at tænde for nanomaterialer til elektroniske applikationerSkematisk af perovskit materiale med organiske molekyler, der kan tilføje til dets elektroniske egenskaber. Kredit:Jingjing Xue og Rui Wang/UCLA Samueli School of Engineering UCLA materialeforsker
Ny måde at tænde for nanomaterialer til elektroniske applikationerSkematisk af perovskit materiale med organiske molekyler, der kan tilføje til dets elektroniske egenskaber. Kredit:Jingjing Xue og Rui Wang/UCLA Samueli School of Engineering UCLA materialeforsker -
 Opbygning af en bedre biosensorpolymerFlere kritiske udfordringer blev overvundet for at udvikle den nye type polymer, der har et stort potentiale for næste generations biosensorer. Kredit:KAUST; Xavier Pita Der er udviklet et nyt org
Opbygning af en bedre biosensorpolymerFlere kritiske udfordringer blev overvundet for at udvikle den nye type polymer, der har et stort potentiale for næste generations biosensorer. Kredit:KAUST; Xavier Pita Der er udviklet et nyt org -
 Teknik afslører, hvordan krystaller dannes på overfladerProcessen med hvordan krystaller dannes på en flad overflade, som vist på dette elektronmikroskopbillede, har været svært at studere i detaljer indtil nu. Kredit:Robert Macfarlane Krystallisations
Teknik afslører, hvordan krystaller dannes på overfladerProcessen med hvordan krystaller dannes på en flad overflade, som vist på dette elektronmikroskopbillede, har været svært at studere i detaljer indtil nu. Kredit:Robert Macfarlane Krystallisations -
 Atomisk tynde perovskites booster til fremtidig elektronikKredit:National Institute for Materials Science WPI-MANA har udviklet verdens højeste ydeevne dielektriske nanofilm ved hjælp af atomisk tynde perovskiter. Denne teknologi kan revolutionere næst
Atomisk tynde perovskites booster til fremtidig elektronikKredit:National Institute for Materials Science WPI-MANA har udviklet verdens højeste ydeevne dielektriske nanofilm ved hjælp af atomisk tynde perovskiter. Denne teknologi kan revolutionere næst
- Hvad er årsagen til, at den aktivton-energi, der kræves til en kemisk reaktion, er nedsat i enzym?…
- Neurale netværk giver mening med komplekse elektroninteraktioner
- Ændrer tilsætning af salt opdriften i almindeligt vand?
- Temperaturspids:Jordforbindelser registrerer høj varme i maj
- Kan vi bruge centripetal acceleration som en fri energikilde?
- Nukleare brændstofalternativer efter Fukushima har udfordringer forude


