Hvorfor har fluor og klor lignende egenskaber?
* Lignende elektronisk konfiguration: Både fluor og klor har syv elektroner i deres yderste skal (Valence Shell). Dette giver dem en stærk tendens til at få et elektron for at opnå en stabil oktetkonfiguration som de ædle gasser. Denne tendens til at få et elektron er det, der definerer deres reaktivitet som halogener.
* ikke -metaller: Begge elementer er ikke -metaller, hvilket betyder, at de mangler metalliske egenskaber som ledningsevne og formbarhed.
* Høj elektronegativitet: De har høj elektronegativitet, hvilket betyder, at de stærkt tiltrækker elektroner i en binding.
* reaktive ikke -metaller: De er meget reaktive ikke -metaller, der let danner ioniske bindinger med metaller og kovalente bindinger med andre ikke -metaller.
Der er dog også nogle vigtige forskelle:
* atomstørrelse: Fluor er mindre end klor på grund af at have færre elektronskaller.
* Elektronegativitet: Fluor har den højeste elektronegativitet af alle elementer, hvilket gør den endnu mere reaktiv end klor.
* Kognings- og smeltepunkter: Fluor findes som en gas ved stuetemperatur, mens klor er en gas ved stuetemperatur, men let flydende under tryk. Dette skyldes de stærkere intermolekylære kræfter mellem klormolekyler sammenlignet med fluormolekyler.
Sammenfattende opstår lighederne mellem fluor og klor fra deres delte position i den periodiske tabel, hvilket fører til lignende elektronkonfigurationer og en stærk tendens til at få elektroner. Imidlertid tilskrives deres forskelle primært til størrelsen af atomet og elektronegativiteten, hvilket påvirker deres reaktivitet og fysiske egenskaber.
 Varme artikler
Varme artikler
-
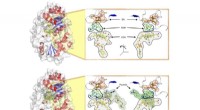 Hvordan et bestemt protein regulerer op til to tredjedele af verdens metanudledningOverfladeillustrationer af enzymet Mmp10, der viser (øverst) proteinet med det komplette sæt af co-faktorer, der kræves for at den enzymatiske reaktion kan forekomme (nemlig:SF4-klyngen, SAM og cobala
Hvordan et bestemt protein regulerer op til to tredjedele af verdens metanudledningOverfladeillustrationer af enzymet Mmp10, der viser (øverst) proteinet med det komplette sæt af co-faktorer, der kræves for at den enzymatiske reaktion kan forekomme (nemlig:SF4-klyngen, SAM og cobala -
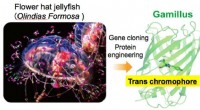 Syretolerant grønt fluorescerende protein til bioimagingEt skema over udviklingen af Gamillus. Gen af det fluorescerende protein blev klonet fra tentakler af blomsterhattevandmænd, og blev konstrueret til at forbedre den monomere egenskab og lysstyrken
Syretolerant grønt fluorescerende protein til bioimagingEt skema over udviklingen af Gamillus. Gen af det fluorescerende protein blev klonet fra tentakler af blomsterhattevandmænd, og blev konstrueret til at forbedre den monomere egenskab og lysstyrken -
 Teknik til at skabe medicin fri for bivirkningerJ. Julius Zhu sagde, at hovedideen bag forskningen var faktisk meget enkel, men det tog os mange år at få denne ting til at fungere. Kredit:Dan Addison, Universitetets kommunikation En ny teknik
Teknik til at skabe medicin fri for bivirkningerJ. Julius Zhu sagde, at hovedideen bag forskningen var faktisk meget enkel, men det tog os mange år at få denne ting til at fungere. Kredit:Dan Addison, Universitetets kommunikation En ny teknik -
 Vandtætte kapsler til måltilførsel af lægemiddelSEM-billeder (opnået fra BSE-detektoren) af PLA-coatede mikropartikler med forskellige masseforhold af CaCO3-partikler i forhold til PLA (a) 0, (b) 0,2. Kredit:Tomsk Polytechnic University (TPU) F
Vandtætte kapsler til måltilførsel af lægemiddelSEM-billeder (opnået fra BSE-detektoren) af PLA-coatede mikropartikler med forskellige masseforhold af CaCO3-partikler i forhold til PLA (a) 0, (b) 0,2. Kredit:Tomsk Polytechnic University (TPU) F
- Mars 2020 pakket ud og klar til test
- Fotosyntese i akvatiske planter
- Når kroppens hastighed fordobles sin acceleration?
- DNA-skade på tværs af en cellulær barriere afhænger af barrierens tykkelse
- Hvor er infrarøde bølger placeret på det elektromagnetiske spektrum?
- Radiostøjkort viser, hvor nødkommunikation kan blive vanskelig


