Hvordan et bestemt protein regulerer op til to tredjedele af verdens metanudledning
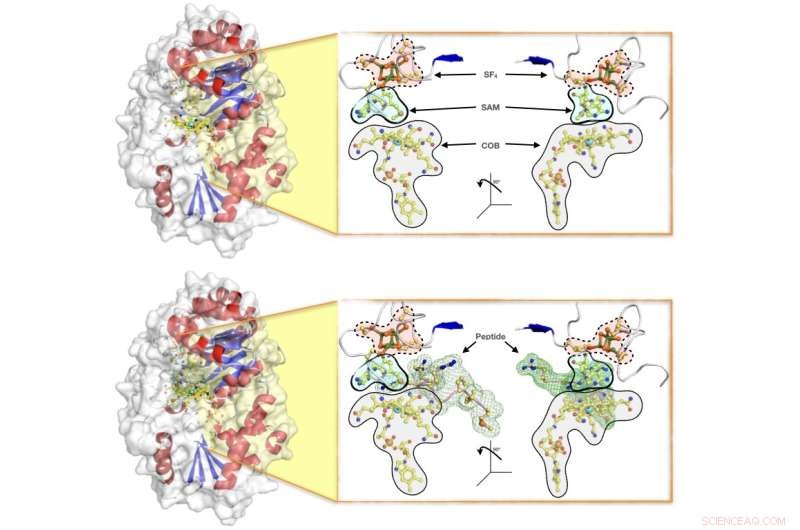
Overfladeillustrationer af enzymet Mmp10, der viser (øverst) proteinet med det komplette sæt af co-faktorer, der kræves for at den enzymatiske reaktion kan forekomme (nemlig:SF4-klyngen, SAM og cobalamin COB), og (nederst) enzymet i virkning, samtidig med at det rummer peptidet til methyloverførsel. Forskerholdet har belyst reaktionens krystallografiske detaljer og foreslået en mekanisme, hvorved proteinet aktiverer et partnerprotein, der står som en væsentlig bidragyder til naturligt forekommende metanproduktion i archaea, som står for omkring to tredjedele af den globale metanproduktion. Kredit:Leo Chavas
Mens metan står for omkring 16% af overfloden i atmosfæren af drivhusgasser - som også omfatter kuldioxid, lattergas, vanddamp - er det mere end 25 gange bedre end kuldioxid til at fange varme. To tredjedele af den globale metanfrigivelse menes at være gennem naturlig emission under anaerob aktivitet af primitive encellede mikroorganismer kaldet archaea. At forstå den præcise mekanisme, hvormed arkæer producerer metan, kan føre til teknologi, der reducerer arkæernes metanproduktion og hjælper i kampen mod global opvarmning.
Archaea adskiller sig fra bakterier hovedsageligt på grund af deres levesteder og energikilder. De såkaldte methanogen archaea udsender metan som et biprodukt af energiproduktion, der er nødvendigt for deres overlevelse. Biomolekylet, der er ansvarligt for metandannelsen, er det såkaldte Methyl-Coenzyme M Reductase (eller MCR) protein, der inducerer den kemiske omdannelse. For at MCR kan katalysere denne reversible reaktion, skal den aktiveres af et partnerprotein, der tilhører superfamilien af B12-afhængig radikal S-Adenosyl-L-Methionin (eller SAM) enzymer.
Superfamilien af radikale SAM-enzymer indeholder over 200.000 uafhængige sekventerede proteiner. Det er blevet forbundet med en lang række naturlige processer, herunder biosyntese af antibiotika og klorofyl. Et af disse nøgleenzymer (Mmp10) er ansvarlig for aktiveringen af MCR-proteinet og er derfor involveret i reguleringen af dets metandannelse. Allestedsnærværelsen af SAM-enzymer på tværs af biosfæren afspejler deres betydning for at katalysere reaktioner, der er fundamentale for alle typer af liv. Imidlertid er mekanismerne, der balancerer deres biologiske aktiviteter, stadig dårligt forstået.
For at tyde aktiviteterne af Mmp10 SAM-enzymet samlede Dr. Olivier Berteau, fra Micalis Institute, Université Paris-Saclay, et hold af videnskabelige eksperter med forskellige komplementære ekspertiseområder, herunder andre forskere fra dette universitet, Aix Marseille University og Synchrotron SOLEIL i Frankrig, samt Nagoya Universitet i Japan. Resultaterne af undersøgelsen blev offentliggjort online i tidsskriftet Nature den 2. februar 2022.
Nøglen til aktiviteten af B12-afhængige radikale SAM-enzymer er en enkel, men kraftfuld mekanisme til at udløse den katalytiske reaktion. Vanskeligheden ved at få enzymet til samtidigt at rumme alle de aktører, der er involveret i reaktionen, har betydet, at der havde været lidt strukturel information tilgængelig, som kunne hjælpe med at forklare, hvordan reaktionen virker.
For at afhjælpe dette kombinerede forskerholdet krystallografiske resultater med biokemiske og biofysiske data for at forklare, hvordan B12-afhængige radikale SAM-proteiner regulerer deres aktivitet, ned til detaljer på atomniveau. Den enzymatiske Mmp10-mekanisme blev afbildet med alle reaktionens aktører til stede.
Resultaterne af denne forskning har implikationer for udviklingen af bioteknologier, der vil kontrollere vigtige enzymatiske begivenheder, især dem, der er involveret i metan-emission, og som hjælper i kampen mod global opvarmning.
Medforfatter professor Leo Chavas, fra Nagoya University, er begejstret over resultaterne af denne langsigtede undersøgelse. "I alt 137 proteiner blev screenet på et førende synkrotronanlæg i Frankrig for at få et glimt af disse sjældne hændelser, som er så svære at fange. Denne forskning åbner også døren til bioteknologisk udvikling."
 Varme artikler
Varme artikler
-
 En intelligent, formformende, selvhelbredende materiale til integreret kunstig muskel og nervevævForskere udvikler et formformende materiale med en hidtil uset multifunktionalitet til blød robotik og bærbar elektronik. Kredit:Soft Machines Lab, Carnegie Mellon University Fremskridt inden for
En intelligent, formformende, selvhelbredende materiale til integreret kunstig muskel og nervevævForskere udvikler et formformende materiale med en hidtil uset multifunktionalitet til blød robotik og bærbar elektronik. Kredit:Soft Machines Lab, Carnegie Mellon University Fremskridt inden for -
 En innovativ proces forhindrer irreversibelt energitab i batterieren kemisk prelithieringsmetode til at maksimere ICE for blandingsanoderne ved hjælp af en reduktiv Li-arene kompleks løsning med reguleret solvationskraft, som gør det muligt for en fuld celle at udvi
En innovativ proces forhindrer irreversibelt energitab i batterieren kemisk prelithieringsmetode til at maksimere ICE for blandingsanoderne ved hjælp af en reduktiv Li-arene kompleks løsning med reguleret solvationskraft, som gør det muligt for en fuld celle at udvi -
 Mælkesyrebakterier kan forlænge fødevarers holdbarhedKredit:CC0 Public Domain Forskere ved National Food Institute, Tekniske Universitet Danmark, har genereret en mælkesyrebakterie, der effektivt udskiller et konserveringsmiddel af fødevarekvalitet,
Mælkesyrebakterier kan forlænge fødevarers holdbarhedKredit:CC0 Public Domain Forskere ved National Food Institute, Tekniske Universitet Danmark, har genereret en mælkesyrebakterie, der effektivt udskiller et konserveringsmiddel af fødevarekvalitet, -
 Elektronstråle styrker genanvendelig nanokompositFigur 1. Kulfiberforstærket plast med cellulosebaseret termoplast. Kredit:Kanazawa University Polymerer forstærket med kulfiber kombinerer styrke og lav vægt. De kan også prale af betydelige grønn
Elektronstråle styrker genanvendelig nanokompositFigur 1. Kulfiberforstærket plast med cellulosebaseret termoplast. Kredit:Kanazawa University Polymerer forstærket med kulfiber kombinerer styrke og lav vægt. De kan også prale af betydelige grønn
- Koordineret havenergiindsats varsler en ny industrisektor
- Forskning i nanopartikler kan forbedre lægemiddellevering gennem huden
- To graders opvarmning kan forårsage tørke i Middelhavsområdet
- Ny undersøgelse afslører forskelle i vitale anvendelser af internet i det sydøstlige Ohio
- Videnskaben sætter historiske påstande på prøve
- Er Sun & Moon Planets?


