Hvordan påvirker opløst cacl2 kogetemperaturen i vandet?
* Kolligative egenskaber: Ændringen i kogepunkt er en kolligativ egenskab, hvilket betyder, at den afhænger af antallet af opløste partikler opløst i opløsningsmidlet, ikke deres specifikke identitet.
* dissociation: Når CaCl2 opløses i vand, adskiller den sig i tre ioner:en ca²⁺ion og to cl⁻ioner. Dette betyder, at et molekyle af CaCl2 producerer tre partikler i opløsning.
* kogepunkthøjde: Tilstedeværelsen af disse opløste ioner forstyrrer ligevægten mellem flydende vandmolekyler og vanddamp. Det bliver sværere for vandmolekyler at flygte ind i dampfasen, hvilket kræver en højere temperatur for at nå kogepunktet.
Kortfattet: Den øgede koncentration af partikler (ioner) i vandet på grund af den opløste CaCl2 hæver kogepunktet.
Vigtig note: Størrelsen af kogepunkthøjden er direkte proportional med molaliteten af opløsningen (mol opløst stof pr. Kg opløsningsmiddel). Så en højere koncentration af CaCl2 vil føre til en større stigning i kogepunktet.
Sidste artikelHvad er balance -ligningen for NaCl Plus BACL2?
Næste artikelEr magnesiumoxid en base eller alkali?
 Varme artikler
Varme artikler
-
 Feltresponsive mekaniske metamaterialer (FRMM'er)Struktur og reologiske test af MR-væske som reaktion på påførte magnetiske felter. (A) Optisk billede af MR-væsken, der danner en væskepool på et plant substrat i fravær af et magnetfelt. (B) Optisk b
Feltresponsive mekaniske metamaterialer (FRMM'er)Struktur og reologiske test af MR-væske som reaktion på påførte magnetiske felter. (A) Optisk billede af MR-væsken, der danner en væskepool på et plant substrat i fravær af et magnetfelt. (B) Optisk b -
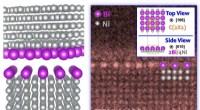 Bestilt, segregation-inducerede overbygninger ved generelle korngrænserAtomistiske modeller og atomopløsning STEM HAADF (scanning transmission elektronmikroskopisk højvinklet ringformet mørkefelt) billeder, der viser tre eksempler på segregation-inducerede overbygninger
Bestilt, segregation-inducerede overbygninger ved generelle korngrænserAtomistiske modeller og atomopløsning STEM HAADF (scanning transmission elektronmikroskopisk højvinklet ringformet mørkefelt) billeder, der viser tre eksempler på segregation-inducerede overbygninger -
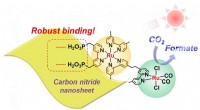 Nyt kulnitridmateriale kombineret med ruthenium forbedrer CO2-reduktionen i synligt lys i vandForskere observerede robust binding mellem rutheniummetalkomplekset og carbonnitrid nanoplader under synligt lys i vandig opløsning. Kredit: Angew. Chem. Med den igangværende udtømning af fossile
Nyt kulnitridmateriale kombineret med ruthenium forbedrer CO2-reduktionen i synligt lys i vandForskere observerede robust binding mellem rutheniummetalkomplekset og carbonnitrid nanoplader under synligt lys i vandig opløsning. Kredit: Angew. Chem. Med den igangværende udtømning af fossile -
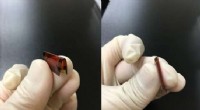 Gennemfyldt med huller:Gør fleksibel tyndfilmselektronik mere holdbarGentagen bøjning forårsager uoprettelig skade på fleksible ledere i form af mikroskopiske revner. At udvikle omkostningseffektive måder at løse dette problem på er en forudsætning, før fleksible elekt
Gennemfyldt med huller:Gør fleksibel tyndfilmselektronik mere holdbarGentagen bøjning forårsager uoprettelig skade på fleksible ledere i form af mikroskopiske revner. At udvikle omkostningseffektive måder at løse dette problem på er en forudsætning, før fleksible elekt
- Hvordan adskiller tilstandene af stoffer sig med hensyn til deres partikler?
- Hvem opfandt lysmikroskopet i 1600 -tallet?
- Brug af palladium til at løse kontaktproblemer med nedgravede oxid-tyndfilmtransistorer
- Hvad er komas koma?
- Hvordan ledning i Thermos fungerer?
- Er der en sammenhæng mellem gaspriser og fedme?


