Hvad er den molekylære form af ALCL6?
Her er hvorfor:
* aluminium (AL) har tre valenselektroner.
* klor (Cl) Har syv valenselektroner.
* I ALCL6 er aluminium bundet til seks chloratomer. Dette betyder, at aluminiumatomet har seks bindingspar elektroner og ingen ensomme par.
I henhold til VSEPR (Valence Shell Electron Pair Repulsion) teori, vil seks bindingspar omkring et centralt atom arrangere sig i en octahedral form for at minimere elektronafvisningen.
Derfor har ALCL6 en octahedral molekylær form.
 Varme artikler
Varme artikler
-
 Elektrokemi skyller antibiotikaresistente proteiner udKredit:EPFL Alain Herzog /Yingdi Zhu, Horst Pick EPFL-forskere, arbejder i samarbejde med Valais Hospital i Sion og Fudan University i Shanghai, har udviklet en metode til at analysere bakterier,
Elektrokemi skyller antibiotikaresistente proteiner udKredit:EPFL Alain Herzog /Yingdi Zhu, Horst Pick EPFL-forskere, arbejder i samarbejde med Valais Hospital i Sion og Fudan University i Shanghai, har udviklet en metode til at analysere bakterier, -
 At gøre alkohol til nøgleingredienser til ny medicinForskere har fundet en måde at omdanne alkohol til aminosyrer, afgørende komponenter i mange lægemidler. Kredit:Unsplash Kemikere har fundet en måde at omdanne alkohol til aminosyrer, livets bygge
At gøre alkohol til nøgleingredienser til ny medicinForskere har fundet en måde at omdanne alkohol til aminosyrer, afgørende komponenter i mange lægemidler. Kredit:Unsplash Kemikere har fundet en måde at omdanne alkohol til aminosyrer, livets bygge -
 Atomindstilling på kobolt muliggør en ottedobbelt stigning i hydrogenperoxidproduktionen3D-billede af enkelte koboltatomer på nitrogendoperet grafen. Det var afgørende for denne undersøgelse at kontrollere koordineringsmiljøet for et enkelt koboltatom, da denne koordineringsstruktur dire
Atomindstilling på kobolt muliggør en ottedobbelt stigning i hydrogenperoxidproduktionen3D-billede af enkelte koboltatomer på nitrogendoperet grafen. Det var afgørende for denne undersøgelse at kontrollere koordineringsmiljøet for et enkelt koboltatom, da denne koordineringsstruktur dire -
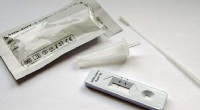 Ny forskning finder måder at forbedre nøjagtigheden af laterale flowtestKredit:Kings College London Forskning offentliggjort i tidsskriftet ACS materialer og grænseflader har givet ny forståelse for, hvordan falsk-negative resultater i laterale flowtest forekommer o
Ny forskning finder måder at forbedre nøjagtigheden af laterale flowtestKredit:Kings College London Forskning offentliggjort i tidsskriftet ACS materialer og grænseflader har givet ny forståelse for, hvordan falsk-negative resultater i laterale flowtest forekommer o
- Facebook forbyder konspirationsteoretikere, kontroversiel sort aktivist
- Nanopartikler kan forbedre kræftbehandlingen
- Hvad er en reaktant i kemisk ligning?
- Hvilke medier kan mekaniske bølger bevæge sig igennem?
- Hvilken jord har en blanding af sand og fin ler?
- Komposterbare fødevarebeholdere kan frigive PFAS til miljøet


