Hvad er reaktionen af jernsulfatopløsning med kaliumpermanganat?
Her er en sammenbrud af reaktionen:
* reaktanter:
* Jern (ii) sulfat (feso₄)
* Kaliumpermanganat (kmno₄)
* Syre (typisk svovlsyre, H₂so₄) er påkrævet for at tilvejebringe det sure miljø til reaktionen for at fortsætte.
* Produkter:
* Jern (III) sulfat (Fe₂ (SO₄) ₃)
* Mangan (II) Sulfat (MNSO₄)
* Kaliumsulfat (k₂so₄)
* Vand (H₂O)
Den afbalancerede kemiske ligning:
10feso₄ + 2 kmno₄ + 8h₂so₄ → 5fe₂ (so₄) ₃ + 2mnso₄ + k₂so₄ + 8h₂o
Forklaring:
* Oxidation: Jern (II) -ioner (Fe²⁺) oxideres til jern (III) -ioner (Fe³⁺) ved at miste en elektron hver.
* reduktion: Permanganationer (MnO₄⁻) reduceres til mangan (II) -ioner (Mn²⁺) ved at få fem elektroner hver.
Observationer:
* Den lilla farve på kaliumpermanganatopløsningen falmer, når den reagerer med jern (II) sulfatopløsningen.
* Opløsningen bliver lysegul på grund af dannelsen af jern (III) sulfat.
Vigtige noter:
* Reaktionen kræver, at et surt medium for permanganationerne fungerer som et oxidationsmiddel.
* Reaktionen er også følsom over for temperatur og koncentration.
* Reaktionen anvendes i titreringsanalyse til at bestemme koncentrationen af jern (II) -ioner i en opløsning.
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse aspekter!
 Varme artikler
Varme artikler
-
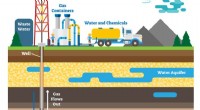 Mekanisme ansvarlig for at skabe halogenerede organiske forbindelser i fracking opdagetForskning fra Kim Parkers laboratorium har fastslået, at tilstedeværelsen af halogenradikaler er en nøgle til dannelsen af halogenerede organiske forbindelser, som er farlige for menneskers sundhe
Mekanisme ansvarlig for at skabe halogenerede organiske forbindelser i fracking opdagetForskning fra Kim Parkers laboratorium har fastslået, at tilstedeværelsen af halogenradikaler er en nøgle til dannelsen af halogenerede organiske forbindelser, som er farlige for menneskers sundhe -
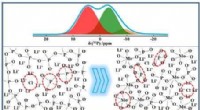 Forskere undersøger strukturen af fosfat-ionisk ledende glas ved hjælp af solid-state NMRStrukturudviklingen af hurtige ionledende glas karakteriseret ved brug af solid-state NMR-teknologier. Kredit:SIOM Glasagtige hurtige ioniske ledere kan bruges som faste elektrolytter, katode ma
Forskere undersøger strukturen af fosfat-ionisk ledende glas ved hjælp af solid-state NMRStrukturudviklingen af hurtige ionledende glas karakteriseret ved brug af solid-state NMR-teknologier. Kredit:SIOM Glasagtige hurtige ioniske ledere kan bruges som faste elektrolytter, katode ma -
 Selvsamling af stærkt porøse krystallinske partikler til nye fotoniske materialer til registrering…Kredit:ICN2 I et laboratorium lige uden for Barcelona, små partikler arrangerer sig selv i ordnede 3D-strukturer, som små animerede legoklodser, der klikker sig på plads. Disse partikler er meget
Selvsamling af stærkt porøse krystallinske partikler til nye fotoniske materialer til registrering…Kredit:ICN2 I et laboratorium lige uden for Barcelona, små partikler arrangerer sig selv i ordnede 3D-strukturer, som små animerede legoklodser, der klikker sig på plads. Disse partikler er meget -
 Enkel og omkostningseffektiv udvinding af sjældne metaller fra industriaffaldKredit:CC0 Public Domain Mange sjældne metaller er mangelfulde, alligevel efterspørgsel efter brug i elektronik, medicinsk instrumentering, og andre formål fortsætter med at stige. Som affald, dis
Enkel og omkostningseffektiv udvinding af sjældne metaller fra industriaffaldKredit:CC0 Public Domain Mange sjældne metaller er mangelfulde, alligevel efterspørgsel efter brug i elektronik, medicinsk instrumentering, og andre formål fortsætter med at stige. Som affald, dis
- En Nephon består af en nyrecorpuscle, og hvad?
- Hvad var det højeste bjerg i verden, før Mount Everest blev opdaget?
- En ulempe ved at bruge vind til at generere elektricitet?
- Opbygning af en bæredygtig livsstil én vane ad gangen
- Hvad angår Hachures på et topografisk kort?
- Ny nanoteknologi identificerer kemisk sammensætning og struktur af urenheder i luft, flydende og le…


