Er natriumchlorid en fast væske eller gas?
Her er hvorfor:
* ionisk binding: Natriumchlorid dannes af ioniske bindinger mellem positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-). Disse stærke elektrostatiske attraktioner holder ionerne sammen i en stiv, krystallinsk struktur.
* højt smeltepunkt: De stærke bindinger kræver en masse energi for at bryde, hvilket resulterer i et højt smeltepunkt på 801 ° C (1474 ° F).
* stuetemperatur: Ved normale temperaturer opretholder natriumchlorid sin faste struktur.
 Varme artikler
Varme artikler
-
 Molekylær kirurgi omformer levende væv med elektricitet, men uden indsnitEn ny ikke-invasiv proces kan ændre kurven for en hornhinde fra den, der ses i blåt i a) til den nye position, der ses med rød i b) for at løse synsproblemer. Kredit:Rachel Qu, Anna Stokolosa, Charlot
Molekylær kirurgi omformer levende væv med elektricitet, men uden indsnitEn ny ikke-invasiv proces kan ændre kurven for en hornhinde fra den, der ses i blåt i a) til den nye position, der ses med rød i b) for at løse synsproblemer. Kredit:Rachel Qu, Anna Stokolosa, Charlot -
 En computermodel har lært at opdage prostatakræftKredit:CC0 Public Domain Forskere ved TSU Laboratory of Biophotonics, arbejder med Tomsk National Research Medical Center (TNIMC) onkologer, har udviklet en ny tilgang til diagnosticering af adeno
En computermodel har lært at opdage prostatakræftKredit:CC0 Public Domain Forskere ved TSU Laboratory of Biophotonics, arbejder med Tomsk National Research Medical Center (TNIMC) onkologer, har udviklet en ny tilgang til diagnosticering af adeno -
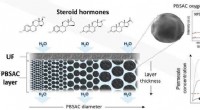 Effektiv fjernelse af steroidhormoner fra vandFiltreringssystemer med den halvgennemtrængelige membran (Ultrafiltration-UF) og et lag aktivt kul (polymerbaseret sfærisk aktivt kul-PBSAC). Kredit:IAMT/KIT Mikroforurenende stoffer forurener van
Effektiv fjernelse af steroidhormoner fra vandFiltreringssystemer med den halvgennemtrængelige membran (Ultrafiltration-UF) og et lag aktivt kul (polymerbaseret sfærisk aktivt kul-PBSAC). Kredit:IAMT/KIT Mikroforurenende stoffer forurener van -
 Udvidelse af omfanget af epoxidringåbningsreaktioner med zirconocenForskere demonstrerer for første gang en epoxid-ringåbningsreaktion katalyseret af zirconocen under synligt lys. Kredit:Waseda University Epoxider tilhører en klasse af organiske forbindelser kalde
Udvidelse af omfanget af epoxidringåbningsreaktioner med zirconocenForskere demonstrerer for første gang en epoxid-ringåbningsreaktion katalyseret af zirconocen under synligt lys. Kredit:Waseda University Epoxider tilhører en klasse af organiske forbindelser kalde
- Forskere udvikler en måde at bedre forudsige korrosion fra råolie
- Hvor meget salt ville svare til 242 mg natrium?
- En blinkende fisk afslører ledetråde til, hvordan vores forfædre udviklede sig fra vandland
- Hvad afhænger Newton Second Law of Motion af?
- Hvor mange elementer er der i calciumchlorid?
- Forskere foreslår en ny måde at generere en lyskilde lavet af sammenfiltrede fotoner


