Hvorfor danner hexan ikke en opløsning med vand?
* hexan (C6H14) er et ikke -polært molekyle: Det består af kun carbon- og hydrogenatomer, som har lignende elektronegativitet. Dette betyder, at elektronerne deles næsten lige så, hvilket resulterer i ingen signifikant ladningsadskillelse inden for molekylet.
* vand (H2O) er et polært molekyle: Oxygen er mere elektronegativ end brint, hvilket fører til en delvis negativ ladning på iltatomet og delvis positive ladninger på brintatomerne. Dette skaber et dipolmoment, hvilket gør vandpolar.
"som opløser som": Dette princip siger, at stoffer med lignende polariteter har en tendens til at opløses i hinanden. Da hexan er ikke -polær og vand er polær, er de ikke kompatible.
Intermolekylære kræfter:
* hexan er primært afhængig af London Dispersion Forces , svage midlertidige attraktioner mellem molekyler på grund af midlertidige udsving i elektronfordeling.
* vand Bruger stærk hydrogenbinding , en speciel type dipol-dipolinteraktion, hvor hydrogenatomer tiltrækkes af stærkt elektronegative atomer som ilt.
De stærke brintbindinger i vand er meget vanskeligere at overvinde af de svage London -spredningskræfter i hexan. Dette forhindrer de to stoffer i at danne en homogen blanding, og de adskiller sig i forskellige lag.
Sidste artikelHvorfor reagerer ikke aluminium med hyrdochlorsyrer?
Næste artikelHvad er duktiliteten af kulstof?
 Varme artikler
Varme artikler
-
 Fremtiden for plastik – genbruge det dårlige og opmuntre det godePlastforurening:kasserede plastikposer er en fare for livet i havet. Kredit:Richard Whitcombe/Shutterstock, CC BY-ND Plast har fået et dårligt navn, hovedsagelig af to grunde:de fleste er lavet af
Fremtiden for plastik – genbruge det dårlige og opmuntre det godePlastforurening:kasserede plastikposer er en fare for livet i havet. Kredit:Richard Whitcombe/Shutterstock, CC BY-ND Plast har fået et dårligt navn, hovedsagelig af to grunde:de fleste er lavet af -
 Kuldioxid-til-methanol-proces forbedret med katalysatorChunshan Song, venstre, og Xiao Jiang er to Penn State-forskere, der undersøger måder at bruge kuldioxid som råmateriale til at skabe brændstoffer og materialer. Song er direktør for EMS Energy Instit
Kuldioxid-til-methanol-proces forbedret med katalysatorChunshan Song, venstre, og Xiao Jiang er to Penn State-forskere, der undersøger måder at bruge kuldioxid som råmateriale til at skabe brændstoffer og materialer. Song er direktør for EMS Energy Instit -
 Nyligt syntetiseret svampemasse kan tænde en selvdestruerende knap for kræftKredit:Pixabay/CC0 Public Domain Kræftceller bruger en særlig teknik til at formere sig:De sletter deres programmerede død -gen gennem mutation, og tilsyneladende glemmer at dø, når deres levetid
Nyligt syntetiseret svampemasse kan tænde en selvdestruerende knap for kræftKredit:Pixabay/CC0 Public Domain Kræftceller bruger en særlig teknik til at formere sig:De sletter deres programmerede død -gen gennem mutation, og tilsyneladende glemmer at dø, når deres levetid -
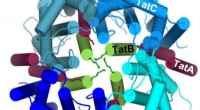 Biokemikere undersøger transporten af store proteiner gennem bakterielle cellemembranerFire TatC-molekyler (blå) danner en cirkel omkring fire TatB-molekyler (grøn) for at danne et hulrum i midten, hvori det protein, der skal transporteres, kan indsættes nedefra. Kredit: Journal of Biol
Biokemikere undersøger transporten af store proteiner gennem bakterielle cellemembranerFire TatC-molekyler (blå) danner en cirkel omkring fire TatB-molekyler (grøn) for at danne et hulrum i midten, hvori det protein, der skal transporteres, kan indsættes nedefra. Kredit: Journal of Biol
- Brug af et Colorimeter
- Hvis en radiobølge vibrerer ved 80,0 MHz, hvad er dens bølgelængde?
- Hvilken egenskab ved stof ville være anderledes i det ydre rum end på jorden?
- Hvad er overførslen af termisk energi ved kollisioner Partikler betyder noget?
- Hvad er lighederne og forskelle mellem gletscheriske kontinentale gletsjere?
- Rester gravet fra Japans massegrav tyder på epidemi i 1800-tallet


