Hvorfor er vand og natrium så reaktiv?
Natriums reaktivitet:
* stærkt reaktivt metal: Natrium er et meget reaktivt alkalimetal. Dens ydre elektron går let tabt, hvilket gør det ivrig efter at donere en elektron til at danne en positiv ion (Na+).
* lav ioniseringsenergi: Det kræver relativt lidt energi at fjerne det ydre elektron, hvilket gør natrium let tilgængelig for kemiske reaktioner.
* Elektropositiv karakter: Natrium har en stærk tendens til at miste elektroner, hvilket gør det til et kraftfuldt reduktionsmiddel.
Vands reaktivitet:
* polært molekyle: Water's struktur har en lidt positiv side (brint) og en lidt negativ side (ilt) på grund af ujævn elektronfordeling. Denne polaritet gør det til et godt opløsningsmiddel for mange stoffer.
* amfoterisk natur: Vand kan fungere som både en syre og en base, hvilket gør det i stand til at deltage i forskellige kemiske reaktioner.
Hvorfor natrium og vand reagerer voldsomt:
Når natrium kommer i kontakt med vand, sker følgende:
1. Natrium donerer et elektron til vand: Den meget reaktive natrium mister let sit ydre elektron til den lidt positive brintside af vandmolekylet.
2. Dannelse af natriumhydroxid og brintgas: Denne elektronoverførsel danner natriumhydroxid (NaOH) og brintgas (H2).
3. eksoterm reaktion: Reaktionen frigiver en betydelig mængde varme, hvilket får brintgassen til at antænde og eksplodere.
Kortfattet:
Natriums høje reaktivitet og dens stærke tendens til at donere elektroner kombineret med vandets polaritet og amfoterisk karakter skaber en meget eksoterm reaktion, der producerer brintgas og varme, hvilket resulterer i en voldelig eksplosion.
 Varme artikler
Varme artikler
-
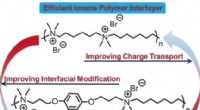 Fullerener bygger bro over ledende kløft i organisk fotovoltaikKredit:Wiley Organisk solceller har opnået bemærkelsesværdigt høje effektiviteter, men at finde optimale kombinationer af materialer til højtydende organiske solceller, som også er økonomisk konku
Fullerener bygger bro over ledende kløft i organisk fotovoltaikKredit:Wiley Organisk solceller har opnået bemærkelsesværdigt høje effektiviteter, men at finde optimale kombinationer af materialer til højtydende organiske solceller, som også er økonomisk konku -
 Team henter inspiration fra naturlige vidundere til at lave nye materialerProfessor LaShanda Korley (til venstre) efterlignede arkitekturen af børsteormens kæbesystem ved at tilføje en zink-koordineret supramolekylær polymer i et kovalent tværbundet polyethylenglycol-netv
Team henter inspiration fra naturlige vidundere til at lave nye materialerProfessor LaShanda Korley (til venstre) efterlignede arkitekturen af børsteormens kæbesystem ved at tilføje en zink-koordineret supramolekylær polymer i et kovalent tværbundet polyethylenglycol-netv -
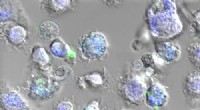 En ny slags vaccine baseret på edderkoppesilkeImmunceller, der indtog nanopartikler af edderkoppesilke (i grønt). Endosomerne - den del af cellen, hvori nanopartiklerne frigiver vaccinen - vises i blåt. Kredit:Laboratoire Bourquin – UNIGE For
En ny slags vaccine baseret på edderkoppesilkeImmunceller, der indtog nanopartikler af edderkoppesilke (i grønt). Endosomerne - den del af cellen, hvori nanopartiklerne frigiver vaccinen - vises i blåt. Kredit:Laboratoire Bourquin – UNIGE For -
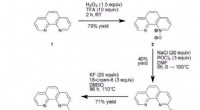 Ny metode til fremstilling af PET-radiotracere i højere radiokemiske udbytterSyntese af radioaktive mærkningsprækursorer og ikke-radioaktive standarder. Kredit:Australian Nuclear Science and Technology Organization (ANSTO) ANSTO-forskere har ledet udviklingen af en ny me
Ny metode til fremstilling af PET-radiotracere i højere radiokemiske udbytterSyntese af radioaktive mærkningsprækursorer og ikke-radioaktive standarder. Kredit:Australian Nuclear Science and Technology Organization (ANSTO) ANSTO-forskere har ledet udviklingen af en ny me
- Hvor meget energi tager at udføre en bestemt mængde arbejde?
- Hvad hedder videnskabsmand, at de studerer jorden, og hvad er der lavet af?
- Retssag fremhæver, hvor komplekst det er at forudsige et vulkanudbrud
- Hvorfor bruger rumfartøjer solcellepaneler?
- Landskab til atomskalaer:Forskere anvender ny tilgang til pyritoxidation
- Mikromotorer bliver superladet med tre motorer


