Hvilke metaloxider er uopløselige i vand, og hvilken opløselig?
Generelt uopløselige metaloxider:
* gruppe 2 (alkaliske jordmetaller): BEO, MGO, CAO, SRO, BAO (undtagen BEO, som er amfoterisk, hvilket betyder, at det kan reagere med både syrer og baser)
* gruppe 3 - 12 (overgangsmetaller): De fleste overgangsmetaloxider er uopløselige, herunder:
* Feo, Fe2O3, Cuo, Zno, Nio, MnO2, Cr2O3 osv.
* gruppe 13 (borgruppe): AL2O3, GA2O3, IN2O3, TL2O3 (undtagen B2O3, som er opløselig)
* gruppe 14 (Carbon Group): SNO2, PBO2, GEO2
* gruppe 15 (nitrogengruppe): AS2O3, SB2O3, BI2O3
Generelt opløselige metaloxider:
* gruppe 1 (alkalimetaller): Li2O, Na2O, K2O, RB2O, CS2O (disse er meget opløselige, reagerer kraftigt med vand til dannelse af hydroxider.)
* gruppe 17 (halogener): CL2O, BR2O, I2O7 (disse er meget reaktive og ustabile.)
* Andet: AG2O (let opløselig)
Faktorer, der påvirker opløselighed:
* ionisk ladning: Højere ionisk ladning (f.eks. Al3+) fører normalt til lavere opløselighed.
* ionisk størrelse: Mindre ioner (f.eks. BE2+) har en tendens til at have en højere ladningstæthed og stærkere interaktioner med vand, hvilket gør dem mere opløselige.
* gitterenergi: Stærkere gitterenergi (energi, der holder ioner sammen i krystalen) fører til lavere opløselighed.
* ph: Opløsningens pH kan påvirke opløseligheden, især for amfoteriske oxider (som BEO og AL2O3).
Vigtige noter:
* "Uopløselig" er et relativt udtryk: Selv "uopløselige" oxider kan opløses i meget lille grad.
* reaktion med vand: Mange metaloxider reagerer med vand for at danne hydroxider, som derefter kan opløses i opløsningen.
* ph -afhængighed: Opløseligheden af nogle metaloxider kan påvirkes i høj grad af pH i opløsningen.
Fortæl mig, hvis du gerne vil have flere detaljer om et specifikt metaloxid!
 Varme artikler
Varme artikler
-
 Forbedring af genleveringsmetoderKredit:Royal Society of Chemistry Forskere i Kina undersøger nye måder at behandle kræft på ved hjælp af genterapi. Vi finder ud af, hvordan deres arbejde inspirerede dette smukke og indviklede de
Forbedring af genleveringsmetoderKredit:Royal Society of Chemistry Forskere i Kina undersøger nye måder at behandle kræft på ved hjælp af genterapi. Vi finder ud af, hvordan deres arbejde inspirerede dette smukke og indviklede de -
 Forskere rapporterer nyt, mere effektiv katalysator til vandspaltningKredit:George Hodan/public domain Fysikere fra University of Houston har opdaget en katalysator, der kan opdele vand i brint og ilt, består af let tilgængelige, billige materialer og fungerer lang
Forskere rapporterer nyt, mere effektiv katalysator til vandspaltningKredit:George Hodan/public domain Fysikere fra University of Houston har opdaget en katalysator, der kan opdele vand i brint og ilt, består af let tilgængelige, billige materialer og fungerer lang -
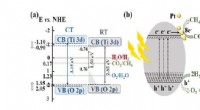 Ny fotokatalysator fremskynder omdannelsen af kuldioxid til kemiske ressourcerEt skematisk diagram, der viser mekanismen for omdannelsen af kuldioxid til metan ved hjælp af det reducerede titaniumdioxid udviklet af holdet. Kredit:DGIST Kuldioxid er en væsentlig årsag til
Ny fotokatalysator fremskynder omdannelsen af kuldioxid til kemiske ressourcerEt skematisk diagram, der viser mekanismen for omdannelsen af kuldioxid til metan ved hjælp af det reducerede titaniumdioxid udviklet af holdet. Kredit:DGIST Kuldioxid er en væsentlig årsag til -
 Video:Hvorfor har vi ikke syntetisk blod endnu?Kredit:The American Chemical Society Der doneres millioner af liter blod rundt om i verden hvert år, men der er stadig ikke nok til alle, der har brug for det. Kemikere har i et århundrede forsøgt
Video:Hvorfor har vi ikke syntetisk blod endnu?Kredit:The American Chemical Society Der doneres millioner af liter blod rundt om i verden hvert år, men der er stadig ikke nok til alle, der har brug for det. Kemikere har i et århundrede forsøgt
- Er Germanium en dirigent eller isolator?
- Hurtige vejrudsving øger risikoen for influenza
- Forældre inden for STEM-områder øger pigernes deltagelse i naturvidenskabelige grader
- Hvordan man bedre kan identificere farlige vulkaner
- Tegn og symptomer på rabies i egern
- Er 5G virkelig grønt, eller vil det forbrænde flere ressourcer?


