Fem grunde til, at jern er et metal, mens svovl ikke -metal?
1. Elektronkonfiguration: Jern har et relativt lille antal valenselektroner (yderste elektroner), som det let mister for at danne positive ioner (kationer). Dette gør det meget reaktivt med andre elementer, især ikke -metaller. I modsætning hertil har svovl et højere antal valenselektroner og har en tendens til at få elektroner til at danne negative ioner (ANION).
2. Metallisk binding: Jernatomer holdes sammen af metalliske bindinger, hvor elektroner delokaliseres og bevæger sig frit gennem strukturen. Dette muliggør høj elektrisk og termisk ledningsevne samt formbarhed og duktilitet. Svovl danner på den anden side kovalente bindinger, hvor elektroner deles mellem atomer, hvilket fører til en mere sprød og mindre ledende struktur.
3. udseende: Jern er typisk skinnende (skinnende), uigennemsigtig og sølvgrå i farve. Disse egenskaber er karakteristiske for metaller. Svovl kan imidlertid være gul eller orange og har et kedeligt, ikke-metallisk udseende.
4. Fysiske egenskaber: Jern udviser egenskaber forbundet med metaller, såsom højt smeltepunkt, høj densitet og god trækstyrke. Svovl har et lavere smeltepunkt, lavere densitet og er sprød.
5. Kemiske egenskaber: Jern reagerer let med ilt for at danne rust (jernoxid), et almindeligt eksempel på korrosion. Det reagerer også med syrer for at danne brintgas. Svovl reagerer med metaller for at danne sulfider, men det reagerer ikke så let med syrer.
Kortfattet: Den vigtigste forskel mellem jern og svovl ligger i deres elektronkonfigurationer og de resulterende bindingsmønstre. Iron's tendens til at miste elektroner og danne metalliske bindinger giver det karakteristiske metalliske egenskaber, mens svovlens præference for at få elektroner og danne kovalente bindinger fører til dens ikke -metalliske opførsel.
Sidste artikelGiv formlen for ioner til stede i natriumphosphat?
Næste artikelHvad er de to vigtigste kræfter i kemisk forvitring?
 Varme artikler
Varme artikler
-
 Uorganiske perovskit absorbere til brug i tyndfilm solcellerVed samtidig fordampning af cæsiumiodid og blyiodid kan der fremstilles tynde lag af CsPbI3 selv ved moderate temperaturer. Et overskud af cæsium fører til stabile perovskitfaser. Kredit:J. Marquez-Pr
Uorganiske perovskit absorbere til brug i tyndfilm solcellerVed samtidig fordampning af cæsiumiodid og blyiodid kan der fremstilles tynde lag af CsPbI3 selv ved moderate temperaturer. Et overskud af cæsium fører til stabile perovskitfaser. Kredit:J. Marquez-Pr -
 Jane Austen -citat kodet i en polymerEt citat fra Jane Austens Mansfield Park skrevet i oligourethanes. Kredit:Sarah Moor Ved hjælp af en ny molekylær datalagringsteknik, forskere ved University of Texas i Austin har kodet et citat f
Jane Austen -citat kodet i en polymerEt citat fra Jane Austens Mansfield Park skrevet i oligourethanes. Kredit:Sarah Moor Ved hjælp af en ny molekylær datalagringsteknik, forskere ved University of Texas i Austin har kodet et citat f -
 Forskere på forkant med udvikling af maskinlæringsmetoder til kemisk opdagelseKredit:CC0 Public Domain Opdagelsen og formuleringen af nye lægemidler, antivirale midler, antibiotika og generelt kemikalier med skræddersyede egenskaber er en lang og omhyggelig proces. Tværfa
Forskere på forkant med udvikling af maskinlæringsmetoder til kemisk opdagelseKredit:CC0 Public Domain Opdagelsen og formuleringen af nye lægemidler, antivirale midler, antibiotika og generelt kemikalier med skræddersyede egenskaber er en lang og omhyggelig proces. Tværfa -
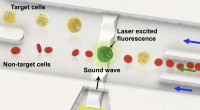 Forskere udviklede enkeltcelleniveau sorteringsteknologi ved hjælp af lydbølgerSkematisk over den fluorescensaktiverede sortering af en enkelt målcelle i en heterogen celleprøve. Kredit:SUTD/Ye Ai Lydbølger muliggør fornemmelsen af hørelse, og er en vigtig måde at kommunik
Forskere udviklede enkeltcelleniveau sorteringsteknologi ved hjælp af lydbølgerSkematisk over den fluorescensaktiverede sortering af en enkelt målcelle i en heterogen celleprøve. Kredit:SUTD/Ye Ai Lydbølger muliggør fornemmelsen af hørelse, og er en vigtig måde at kommunik
- Nye visninger af Jupiter viser hvirvlende skyer på en kæmpe planet
- Hvordan får vi videnskabelig viden?
- Hvad har hver kraft på et objekt?
- Avanceret billedkamera klar til installation på IMAP-rumfartøjer
- Plasmaoscillationer driver gennembrud inden for fusionsenergi
- NASA konstaterer, at den tropiske storm Maliksi svækkes, udvides


