Natrium og kalium viser lignende reaktivitet over for vand Hvilken egenskab besidder disse elementer til fælles?
Her er hvorfor:
* Elektronkonfiguration: Alkalimetaller har kun et elektron i deres yderste skal. Denne enkelt elektron holdes relativt løst og mistes let, hvilket gør dem meget reaktive.
* Elektropositivitet: De er meget elektropositive, hvilket betyder, at de let mister deres yderste elektron for at danne en positiv ion (kation).
* lav ioniseringsenergi: På grund af det svage hold på det yderste elektron har alkalimetaller lave ioniseringsenergier, hvilket betyder, at det kræver lidt energi at fjerne dette elektron.
Når disse elementer reagerer med vand:
1. De mister let deres valenselektron til et hydrogenatom i vand.
2. Dette danner brintgas (H2) og et metalhydroxid.
3.. Reaktionen frigiver en betydelig mængde varme, hvilket ofte får brintgassen til at antænde.
Sammenfattende er den lignende reaktivitet af natrium og kalium over for vand direkte knyttet til deres delte position i gruppe 1 i den periodiske tabel, hvilket fører til en almindelig tendens til let at miste deres enkelt valenselektron.
 Varme artikler
Varme artikler
-
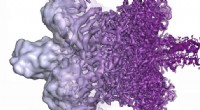 Livet frosset i tid under et elektronmikroskop får en nobelprisElektronmikroskopets opløsning er radikalt forbedret i de sidste par år, fra for det meste at vise formløse klatter (venstre) i 2013 til nu at kunne visualisere proteiner ved atomopløsning (til højre)
Livet frosset i tid under et elektronmikroskop får en nobelprisElektronmikroskopets opløsning er radikalt forbedret i de sidste par år, fra for det meste at vise formløse klatter (venstre) i 2013 til nu at kunne visualisere proteiner ved atomopløsning (til højre) -
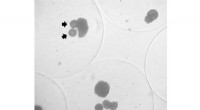 Små lægemiddelleverende kapsler kunne opretholde transplanterede insulinproducerende cellerPancreas-øceller indkapslet sammen med mikrosfærer, der frigiver et lægemiddel, der øger levedygtigheden i miljøer med lavt iltindhold. Mikrosfærerne har pile, der peger på dem; de større klatter er c
Små lægemiddelleverende kapsler kunne opretholde transplanterede insulinproducerende cellerPancreas-øceller indkapslet sammen med mikrosfærer, der frigiver et lægemiddel, der øger levedygtigheden i miljøer med lavt iltindhold. Mikrosfærerne har pile, der peger på dem; de større klatter er c -
 Bæredygtigt byggeri ved hjælp af miljøvenlig betonForskellige former testet for den smeltbare metalfiber. Kredit:Tokyo Institute of Technology Den 18. februar Lektor Masatoshi Kondo (Laboratory for Advanced Nuclear Energy, Institut for Innovativ
Bæredygtigt byggeri ved hjælp af miljøvenlig betonForskellige former testet for den smeltbare metalfiber. Kredit:Tokyo Institute of Technology Den 18. februar Lektor Masatoshi Kondo (Laboratory for Advanced Nuclear Energy, Institut for Innovativ -
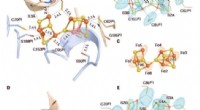 Strukturelt bevis for en dynamisk metallocofaktor under dinitrogenreduktion ved Mo-nitrogenaseDe oxiderede P-klynger i Av1*. Strukturer af P-klynger ved (A til C) grænsefladen mellem kæder A og B [P-klynge (A/B)] og (D til F) grænsefladen mellem kæder C og D [P-klynge (C/D) ] af Av1*. Kæder A
Strukturelt bevis for en dynamisk metallocofaktor under dinitrogenreduktion ved Mo-nitrogenaseDe oxiderede P-klynger i Av1*. Strukturer af P-klynger ved (A til C) grænsefladen mellem kæder A og B [P-klynge (A/B)] og (D til F) grænsefladen mellem kæder C og D [P-klynge (C/D) ] af Av1*. Kæder A


