Hvad er reaktionen af K2CR2O7 med SO2?
k₂cr₂o₇ + 3So₂ + H₂so₄ → K₂so₄ + cr₂ (so₄) ₃ + h₂o
Forklaring:
* kaliumdichromat (k₂cr₂o₇) bliver reduceret, idet Cr⁶⁺ioner i dichromationen (cr₂o₇²⁻) reduceres til cr³⁺ -ioner i krom (III) sulfat (cr₂ (SO₄) ₃).
* svovldioxid (SO₂) bliver oxideret, med svovl i +4 oxidationstilstand oxideret til svovl i +6 oxidationstilstand i sulfationer (SO₄²⁻).
trin-for-trin sammenbrud:
1. Oxidation af SO₂:
* So₂ → So₄²⁻ + 2e⁻ (hvert svovlatom mister 2 elektroner)
2. reduktion af k₂cr₂o₇:
* Cr₂o₇²⁻ + 6E⁻ + 14H⁺ → 2CR³⁺ + 7H₂O (hvert kromatom får 3 elektroner)
3. afbalancering af elektronerne:
* Multiplicer oxidationen halvreaktion med 3 for at afbalancere elektronerne:3SO₂ → 3SO₄²⁻ + 6E⁻
* Nu er elektronforstærkningen og tabet ens.
4. Kombination af halvreaktionerne:
* K₂cr₂o₇ + 3So₂ + 14H⁺ → K₂so₄ + cr₂ (so₄) ₃ + 7H₂O
5. Tilføjelse af h₂so₄:
* Da reaktionen kræver h⁺ioner, tilføjer vi h₂so₄ for at tilvejebringe disse ioner:
* K₂cr₂o₇ + 3so₂ + h₂so₄ → k₂so₄ + cr₂ (so₄) ₃ + h₂o
Vigtig note:
* Denne reaktion udføres ofte under sure forhold, og det er grunden til, at H₂so₄ føjes til reaktionen.
* Reaktionen producerer en grøn opløsning indeholdende krom (III) sulfat (Cr₂ (SO₄) ₃), som er en karakteristisk farveændring, der ofte bruges til at indikere tilstedeværelsen af dichromat.
Sidste artikelReagerer acetylidionen med ethylenoxid?
Næste artikelBeregn masse på 3,011 x 10 23 Ingen nitrogenatomer?
 Varme artikler
Varme artikler
-
 At finde træalternativer til truet ibenholtEn violin med et gribebræt lavet af schweizisk ibenholt. Kredit:Wilhelm Geigenbau AG, Suhr Ligesom mange tropiske træsorter, ibenholt er en truet art, der er vanskelig at bruge, sådan i instrument
At finde træalternativer til truet ibenholtEn violin med et gribebræt lavet af schweizisk ibenholt. Kredit:Wilhelm Geigenbau AG, Suhr Ligesom mange tropiske træsorter, ibenholt er en truet art, der er vanskelig at bruge, sådan i instrument -
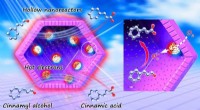 Konstruktion af hule nanoreaktorer til forbedrede fotooxidationerSkematisk diagram af hule nanoreaktorer til fotokatalytisk oxidation af cinnamylalkohol. Kredit:Science China Press Oxidation af primære alkoholer til carboxylsyrer er af betydning i både organisk
Konstruktion af hule nanoreaktorer til forbedrede fotooxidationerSkematisk diagram af hule nanoreaktorer til fotokatalytisk oxidation af cinnamylalkohol. Kredit:Science China Press Oxidation af primære alkoholer til carboxylsyrer er af betydning i både organisk -
 Forskere rapporterer om ny teknik til afisning af overfladerFotografiet viser en af de mønstrede understrukturer, som Zhang og hans kolleger brugte i designet af deres anti-isbelægning. Understrukturerne var med til at forårsage makro-revner i grænsefladen m
Forskere rapporterer om ny teknik til afisning af overfladerFotografiet viser en af de mønstrede understrukturer, som Zhang og hans kolleger brugte i designet af deres anti-isbelægning. Understrukturerne var med til at forårsage makro-revner i grænsefladen m -
 Nye materialer:En vippekontakt til katalyseEn perovskit tyndfilm elektrode, på en ZrO2-krystal. Kredit:TU Wien Elektrokemi spiller en stadig vigtigere rolle:Uanset om det er brændselsceller, elektrolyse eller kemisk energilagring, kemiske
Nye materialer:En vippekontakt til katalyseEn perovskit tyndfilm elektrode, på en ZrO2-krystal. Kredit:TU Wien Elektrokemi spiller en stadig vigtigere rolle:Uanset om det er brændselsceller, elektrolyse eller kemisk energilagring, kemiske
- Vægter vi det samme på månen?
- Kræft på Paleo-diæt? Spørg en, der levede for 1,7 millioner år siden
- Hvilken sekvens viser form for vand fra de koldeste til hotteste temperaturer?
- Hvor mange elektroner er gaver i fluoratom?
- Glas med omskiftelig opacitet kan forbedre solceller og lysdioder
- Sådan fungerer helikoptere


