Hvad er elektronegativitetsforskellen mellem natrium og brom?
1. Slå op på elektronegativitetsværdierne:
* natrium (NA): 0,93
* brom (Br): 2.96
2. Beregn forskellen:
Elektronegativitetsforskel =2,96 - 0,93 = 2,03
Derfor er elektronegativitetsforskellen mellem natrium og brom 2,03.
hvad fortæller dette os?
En stor elektronegativitetsforskel (som denne) indikerer, at bindingen mellem natrium og brom er meget ionisk . Dette betyder, at elektroner overføres fra natriumatomet (mindre elektronegativt) til bromatomet (mere elektronegativt), hvilket resulterer i dannelse af Na+ og BR- ioner.
Sidste artikelHvad er den generelle form for en enkeltudskiftningsreaktion?
Næste artikelEr aluminium en bedre leder end natrium?
 Varme artikler
Varme artikler
-
 Kortlægning af solcellernes energiske landskabKredit:CC0 Public Domain En ny spektroskopisk metode gør det nu muligt at måle og visualisere det energiske landskab inde i solceller baseret på organiske materialer. Det blev udviklet af et forsk
Kortlægning af solcellernes energiske landskabKredit:CC0 Public Domain En ny spektroskopisk metode gør det nu muligt at måle og visualisere det energiske landskab inde i solceller baseret på organiske materialer. Det blev udviklet af et forsk -
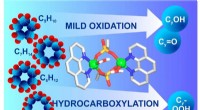 Kemikere udvikler en katalysator til at oxidere alkaner under milde forholdKredit:Natalia Deryugina RUDN-kemikere udviklede en katalysator til at oxidere alkaner uden yderligere opvarmning og under regelmæssigt tryk. Dette vil forenkle processen med at opnå alkoholer, sy
Kemikere udvikler en katalysator til at oxidere alkaner under milde forholdKredit:Natalia Deryugina RUDN-kemikere udviklede en katalysator til at oxidere alkaner uden yderligere opvarmning og under regelmæssigt tryk. Dette vil forenkle processen med at opnå alkoholer, sy -
 Højindeks overflade-eksponerede nanodendritter som ORR elektrokatalysatorVed hjælp af en atmosfære -skiftende strategi efterfulgt af elektrokemisk dealloying, forskere har syntetiseret sammensætningsgraderet PtCu 3 @Pt 3 Cu@Pt nanodendritter, der blotlægger overflader
Højindeks overflade-eksponerede nanodendritter som ORR elektrokatalysatorVed hjælp af en atmosfære -skiftende strategi efterfulgt af elektrokemisk dealloying, forskere har syntetiseret sammensætningsgraderet PtCu 3 @Pt 3 Cu@Pt nanodendritter, der blotlægger overflader -
 Brug af matematik til at forudsige SARS-CoV-2-proteinmutationerEt team af forskere brugte matematik til at forudsige, hvilke områder af SARS-CoV-2 spike-proteinet der er mest tilbøjelige til at mutere. Kredit:Jill Hemman/ORNL, U.S.A. Dept. of Energy Oak Ridge
Brug af matematik til at forudsige SARS-CoV-2-proteinmutationerEt team af forskere brugte matematik til at forudsige, hvilke områder af SARS-CoV-2 spike-proteinet der er mest tilbøjelige til at mutere. Kredit:Jill Hemman/ORNL, U.S.A. Dept. of Energy Oak Ridge
- Hvad er nettobevægelsen af opløste stoffer til regioner lavere koncentration?
- Hvor bruges vindenergi mest i verden?
- LHAASO opdager gigantisk ultrahøjenergi gammastråleboble, der identificerer den første super PeVa…
- Hvor mange grader er der på en firkant?
- Er det sandt eller falsk, at overførsel af termisk energi ved stråling ikke kræver stof?
- Hvor hurtigt rejser alfa -partikler?


