Hvad er den empiriske formel for en forbindelse, der indeholder 3,609 g calcium og 6,384 klor ved masse?
1. Konverter masse til mol:
* calcium (CA): 3,609 g Ca / 40,08 g / mol Ca =0,0900 mol Ca
* klor (Cl): 6,384 g CL / 35,45 g / mol Cl =0,1800 mol CL
2. Find molforholdet:
* Opdel antallet af mol af hvert element med det mindste antal mol:
* CA:0,0900 mol / 0,0900 mol =1
* Cl:0,1800 mol / 0,0900 mol =2
3. Skriv den empiriske formel:
* Molforholdet angiver, at den empiriske formel er cacl₂ .
Derfor er den empiriske formel for forbindelsen cacl₂.
Sidste artikelAlle organiske forbindelser indeholder elementet?
Næste artikelHvad er molfraktionen på 18 mol NaCl i en opløsning 100 vand?
 Varme artikler
Varme artikler
-
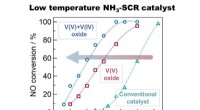 Nye katalysatorer fjerner nitrogenoxidforurenende stoffer ved lavere temperaturerOmdannelseshastighed for nitrogenoxider ved forskellige temperaturer for konventionelle, V (V) oxid og V (IV)+V (V) oxid defekte katalysatorer. Blandingen af V (V) og V (IV) oxider viste en 10 gange
Nye katalysatorer fjerner nitrogenoxidforurenende stoffer ved lavere temperaturerOmdannelseshastighed for nitrogenoxider ved forskellige temperaturer for konventionelle, V (V) oxid og V (IV)+V (V) oxid defekte katalysatorer. Blandingen af V (V) og V (IV) oxider viste en 10 gange -
 Kemiker studerer elektriske felter, mikrofluidik til forbedring af dialyteteknologiJoseph Banovetz, Beatrise Berzina og Robbyn Anand, venstre til højre, oprette en prototype -enhed til at teste separationsydelse i blodplasma. De bruger et fluorescensmikroskop til at følge to sporsto
Kemiker studerer elektriske felter, mikrofluidik til forbedring af dialyteteknologiJoseph Banovetz, Beatrise Berzina og Robbyn Anand, venstre til højre, oprette en prototype -enhed til at teste separationsydelse i blodplasma. De bruger et fluorescensmikroskop til at følge to sporsto -
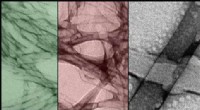 Formskiftende materialer:Brug af lys til at omarrangere makroskopiske strukturerTEM-billeder af selvsamlende nanostrukturer og deres rekombinationer, i falske farver. Kredit:Okinawa Institute of Science and Technology Graduate University - OIST OIST-forskere skaber selvsamlen
Formskiftende materialer:Brug af lys til at omarrangere makroskopiske strukturerTEM-billeder af selvsamlende nanostrukturer og deres rekombinationer, i falske farver. Kredit:Okinawa Institute of Science and Technology Graduate University - OIST OIST-forskere skaber selvsamlen -
 MagLab-forskere opdager termoelektriske egenskaber i lovende materialeklasseMagLab-fysikerne Ryan Baumbach (til venstre) og Kaya Wei studerer en klasse af materialer med lovende termoelektriske egenskaber. Kredit:Stephen Bilenky/National MagLab At udforske et område, der
MagLab-forskere opdager termoelektriske egenskaber i lovende materialeklasseMagLab-fysikerne Ryan Baumbach (til venstre) og Kaya Wei studerer en klasse af materialer med lovende termoelektriske egenskaber. Kredit:Stephen Bilenky/National MagLab At udforske et område, der
- Hvorfor er vand en væske ved stuetemperatur, hvorimod ammoniakgasstemperatur?
- Hvorfor reflekterede månen så meget lys?
- Opfordrer til at stoppe Mexicos fangst af truede marsvin
- Forskere søger efter løsninger til at konstruere en omfattende arbejdsstyrke
- Nulemissionsdieselforbrænding ved hjælp af et ikke-ligevægtsplasma-assisteret MnO2-filter
- Hvor kan man se billeder taget med Hubble -teleskopet?


