Hvorfor er vand en væske ved stuetemperatur, hvorimod ammoniakgasstemperatur?
Hydrogenbinding:
* Vand: Vandmolekyler er meget polære, hvilket betyder, at de har en positiv ende (hydrogenatomerne) og en negativ ende (iltatomet). Disse modsatte ladninger tillader vandmolekyler at danne stærke brintbindinger med hinanden. Disse bindinger er meget stærke og kræver en masse energi for at bryde, hvilket forklarer, hvorfor vand forbliver en væske ved stuetemperatur.
* ammoniak: Ammoniak har også en polær struktur og danner brintbindinger, men de er svagere end dem i vand. Dette skyldes, at nitrogenatomet i ammoniak er mindre elektronegativ end iltatomet i vand, hvilket betyder, at det ikke trækker så stærkt på de delte elektroner. Svagere brintbindinger betyder, at der er behov for mindre energi for at bryde dem, så ammoniak findes som en gas ved stuetemperatur.
Andre faktorer:
* molekylvægt: Selvom det ikke er så signifikant som hydrogenbinding, har ammoniak en lavere molekylvægt end vand, hvilket også bidrager til dets volatilitet (tendens til at fordampe).
Kortfattet: Den vigtigste forskel ligger i styrken af hydrogenbinding. Vands stærkere brintbindinger fører til et højere kogepunkt og en flydende tilstand ved stuetemperatur, mens ammoniaks svagere brintbindinger resulterer i et lavere kogepunkt og en gasformig tilstand ved stuetemperatur.
 Varme artikler
Varme artikler
-
 Forskere leder bakterier med udvidet genetisk kode til at udvikle ekstrem varmetoleranceEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH I de seneste år, forskere har konstrueret bakterier med udvidede genetiske koder, der producerer proteiner fremstillet af et breder
Forskere leder bakterier med udvidet genetisk kode til at udvikle ekstrem varmetoleranceEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH I de seneste år, forskere har konstrueret bakterier med udvidede genetiske koder, der producerer proteiner fremstillet af et breder -
 Den kommende forstyrrelse af OLED-teknologierEn organisk lysemitterende diode (OLED) er en selvlysende, tyndfilmskomponent lavet af organiske halvledende materialer. Da der ikke er behov for siliciumchips, kun pigmentmolekyler disse lys kan prod
Den kommende forstyrrelse af OLED-teknologierEn organisk lysemitterende diode (OLED) er en selvlysende, tyndfilmskomponent lavet af organiske halvledende materialer. Da der ikke er behov for siliciumchips, kun pigmentmolekyler disse lys kan prod -
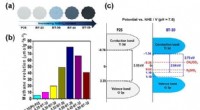 Meget effektiv fotokatalysator, der omdanner kuldioxid til metan(a) Figuren viser farveændringen af fotokatalysatoren udviklet af forskerholdet. Den viser, at den reducerede titaniumdioxid absorberer lys mere mod højre, og farven bliver mørkere.(b) En graf, der
Meget effektiv fotokatalysator, der omdanner kuldioxid til metan(a) Figuren viser farveændringen af fotokatalysatoren udviklet af forskerholdet. Den viser, at den reducerede titaniumdioxid absorberer lys mere mod højre, og farven bliver mørkere.(b) En graf, der -
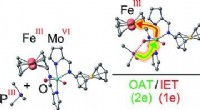 Bioinspireret enzymmodel med redox -switchKredit:Wiley Koblede oxygenoverførsler og elektronoverførselsreaktioner, der anvender kofaktorer, er enzymatiske reaktioner af afgørende betydning for alle livsformer fra bakterier til hvirveldyr.
Bioinspireret enzymmodel med redox -switchKredit:Wiley Koblede oxygenoverførsler og elektronoverførselsreaktioner, der anvender kofaktorer, er enzymatiske reaktioner af afgørende betydning for alle livsformer fra bakterier til hvirveldyr.
- Hvilken energibevægelse brugt af mikrobølgeovn?
- SHINE -software viser data ved hjælp af virtual reality
- Hvad er den elektroniske orbitalkonfiguration for jordtilstand til natrium?
- Ladningen på den polyatomiske ion NO2 er 1- Hvad vil formel for en enhed en forbindelse mellem og v…
- Den anden mindste planet tættest på solen?
- Hvad er gasbevægelserne i granulat på soloverfladen?


