Kan et positivt oplade brintender af vandmolekyler tiltrække chloridioner?
Her er hvorfor:
* vand er polært: Vandmolekyler har en bøjet form på grund af iltatomets højere elektronegativitet. Dette betyder, at molekylets ilt ende har en delvis negativ ladning (Δ-), og brintenderne har delvis positive ladninger (δ+).
* Chloridioner er negativt ladet: Chloridioner (Cl-) bærer en fuld negativ ladning.
* modsatte afgifter tiltrækker: De delvise positive ladninger på brintens ender af vandmolekyler vil blive tiltrukket af de negativt ladede chloridioner.
Denne attraktion er en vigtig årsag til, at salte som natriumchlorid (NaCl) opløses i vand. De positive natriumioner (Na+) tiltrækkes af iltenden af vandmolekyler, mens chloriderne tiltrækkes af brintenderne. Denne interaktion hjælper med at bryde saltet ionisk gitter og give ionerne mulighed for at sprede sig i vandet.
 Varme artikler
Varme artikler
-
 Forskere finder, at 2-D overgangsmetalkarbider reagerer med vand, åbner en dør til deres ukendte k…MXenes reaktivitet over for vand er vist i dette eksperiment, hvor en Ti-carbid MXene overlever længere i en iltmættet, ikke-vandigt system, i modsætning til det samme MXene dispergeret i argon-mættet
Forskere finder, at 2-D overgangsmetalkarbider reagerer med vand, åbner en dør til deres ukendte k…MXenes reaktivitet over for vand er vist i dette eksperiment, hvor en Ti-carbid MXene overlever længere i en iltmættet, ikke-vandigt system, i modsætning til det samme MXene dispergeret i argon-mættet -
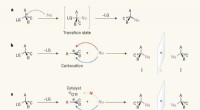 Brug af en SN1-reaktion til at lave kvartære stereocentreSpejlbillede-selektivitet i substitutionsreaktioner. en, I en SN2-reaktion, en reaktant kaldet en nukleofil (Nu; prikker angiver et ensomt elektronpar) angriber et kulstofatom i et organisk molekyle f
Brug af en SN1-reaktion til at lave kvartære stereocentreSpejlbillede-selektivitet i substitutionsreaktioner. en, I en SN2-reaktion, en reaktant kaldet en nukleofil (Nu; prikker angiver et ensomt elektronpar) angriber et kulstofatom i et organisk molekyle f -
 Bæredygtig transport:Rensning af luften på nitrogendopingAktive nitrogenatomer i kulstofkatalysatoren. Kredit:University of Tsukuba Proton-udvekslingsmembran (PEM) brændselsceller er en energilagringsteknologi, der vil hjælpe med at sænke transportens m
Bæredygtig transport:Rensning af luften på nitrogendopingAktive nitrogenatomer i kulstofkatalysatoren. Kredit:University of Tsukuba Proton-udvekslingsmembran (PEM) brændselsceller er en energilagringsteknologi, der vil hjælpe med at sænke transportens m -
 Identifikation af designermedicin taget af overdosispatienterLægemidler frigivet fra testpatronen (i midten) identificeres af et massespektrometer (venstre). Kredit:Greta Ren Overdosering af stoffer tager en enorm vejafgift på folkesundheden, med potente sy
Identifikation af designermedicin taget af overdosispatienterLægemidler frigivet fra testpatronen (i midten) identificeres af et massespektrometer (venstre). Kredit:Greta Ren Overdosering af stoffer tager en enorm vejafgift på folkesundheden, med potente sy
- De mest almindelige organiske molekyler i celler
- Jonglering med regninger kan være en vigtig risikoindikator for fødevareusikkerhed
- Balanceret ligning for fuldstændig forbrænding af cyclooctan?
- Science Fair Project om effekten af kulsyreholdige drikkevarer på kød
- Hvad er produkter af cellulær respiration?
- Kina beskylder USA for at forsøge at blokere for sin teknologiske udvikling


