Hvis en forbindelse er 26 procent nitrogen og 74 ilt, hvad den empriske formel?
1. Antag en 100 g prøve
* Dette gør beregningerne lettere. Hvis du har 26% nitrogen, har du 26 g nitrogen i din 100 g prøve.
* Tilsvarende har du 74 g ilt.
2. Konverter gram til mol
* nitrogen: Del massen af nitrogen (26 g) med dens molære masse (14,01 g/mol)
* 26 g / 14,01 g / mol =1,86 mol N
* ilt: Del massen af ilt (74 g) med dens molære masse (16,00 g/mol)
* 74 g / 16,00 g / mol =4,63 mol o
3. Find det enkleste molforhold
* Opdel begge molværdier med de mindre af de to (1,86 mol N)
* Nitrogen:1,86 mol / 1,86 mol =1
* Oxygen:4,63 mol / 1,86 mol =2,49
* Da vi har brug for hele talforhold, runde 2,49 til det nærmeste hele tal, som er 2.
4. Skriv den empiriske formel
* Den empiriske formel er n₁o₂ eller blot no₂ .
Sidste artikelEr aluminium mere elektronegativ end natrium?
Næste artikelHvordan adskiller du kobbersulfat og svovl?
 Varme artikler
Varme artikler
-
 Ny metode til hurtigere og enklere produktion af lipiderede proteinerI Journal of the American Chemical Society, forskere fra Graz University of Technology og University of Wien præsenterer en ny metode til produktion af lipidproteiner. Sammenlignet med etablerede meto
Ny metode til hurtigere og enklere produktion af lipiderede proteinerI Journal of the American Chemical Society, forskere fra Graz University of Technology og University of Wien præsenterer en ny metode til produktion af lipidproteiner. Sammenlignet med etablerede meto -
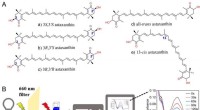 Evaluering af antioxidantaktiviteter af astaxanthinisomerer mod singlet oxygenA. Strukturer af stereoisomerer af astaxanthin; B. Måling af singlet-iltslukningskapaciteten af antioxidanter. Kredit:Zheng Xinxin Forskere ledet af prof. Huang Qing fra Hefei Institutes of Physi
Evaluering af antioxidantaktiviteter af astaxanthinisomerer mod singlet oxygenA. Strukturer af stereoisomerer af astaxanthin; B. Måling af singlet-iltslukningskapaciteten af antioxidanter. Kredit:Zheng Xinxin Forskere ledet af prof. Huang Qing fra Hefei Institutes of Physi -
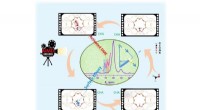 Undersøgelse afslører dannelsesmekanismen for den første carbon-carbon-binding i MTO-processenAfsløring af hele de første C-C-bindingsdannelsesprocesser i MTO-reaktion:baseret på in situ NMR spektroskopiske beviser og avanceret ab initio molekylær dynamik (AIMD) teoretisk beregningsmetode. Kre
Undersøgelse afslører dannelsesmekanismen for den første carbon-carbon-binding i MTO-processenAfsløring af hele de første C-C-bindingsdannelsesprocesser i MTO-reaktion:baseret på in situ NMR spektroskopiske beviser og avanceret ab initio molekylær dynamik (AIMD) teoretisk beregningsmetode. Kre -
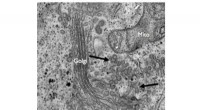 Enzym har vist sig at kontrollere dannelsen af kollagenbærere og hæmme kollagensekretionElektronmikroskopi-billeddannelse afslører tilstedeværelsen af mange indbyrdes forbundne vesikler, som ser ud til at opføre sig som kollagenbærere (angivet med pile). Kredit: Biokemisk og biofysisk
Enzym har vist sig at kontrollere dannelsen af kollagenbærere og hæmme kollagensekretionElektronmikroskopi-billeddannelse afslører tilstedeværelsen af mange indbyrdes forbundne vesikler, som ser ud til at opføre sig som kollagenbærere (angivet med pile). Kredit: Biokemisk og biofysisk
- Ny teknologi kan opdage antivirus-antistof på 20 minutter
- Er der rosa flamingoer på Hawaii?
- Hvilken bygning er der på bagsiden af et nikkel?
- 'Kollektivt sind' bygger bro mellem samfundsmæssige skel:Forskning udforsker, hvordan det at se det…
- Hvordan tillader strukturer i en plantecelle at fungere som en del af fødevarekæden?
- Sådan beregnes fænotypisk forhold


