Er nitrogen og ilt en ionisk forbindelse?
* Elektronegativitet: Nitrogen og ilt er begge meget elektronegative elementer. Dette betyder, at de har en stærk attraktion for elektroner. Forskellen i elektronegativitet mellem nitrogen og ilt er ikke stor nok til at skabe en komplet overførsel af elektroner, hvilket er nødvendigt til dannelse af ionisk binding.
* kovalent binding: I stedet for at danne ioner deler nitrogen og iltelektroner til dannelse af kovalente bindinger. Denne deling skaber et stabilt molekyle. Eksempler på kovalente forbindelser dannet af nitrogen og ilt inkluderer:
* nitrogenmonoxid (NO)
* nitrogendioxid (NO2)
* nitrogenoxid (N2O)
Key Takeaway: Ioniske forbindelser dannes typisk mellem metaller (som har en tendens til at miste elektroner) og ikke -metaller (som har en tendens til at vinde elektroner). Mens nitrogen og ilt begge er ikke -metaller, er deres elektronegativitetsforskel ikke signifikant nok til at resultere i ionisk binding.
Sidste artikelHvad er ladningen i coulombs af kerne et kloratom?
Næste artikelHvordan kan opløsning af Tellurium metal?
 Varme artikler
Varme artikler
-
 Forskere rydder bane for tinbaserede perovskit-solcellerKredit:CC0 Public Domain Forskere ved University of Surrey mener, at deres tinbaserede perovskit-solcelle kan rydde banen for solpanelteknologi til at tage fart og hjælpe Storbritannien med at nå
Forskere rydder bane for tinbaserede perovskit-solcellerKredit:CC0 Public Domain Forskere ved University of Surrey mener, at deres tinbaserede perovskit-solcelle kan rydde banen for solpanelteknologi til at tage fart og hjælpe Storbritannien med at nå -
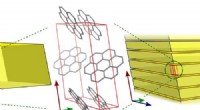 Fluorescerende krystal mysterium løstSkematisk, der viser den ikke-lagdelte krystalstruktur af syntetisk coronen (venstre) og den lagdelte struktur af naturlig karpatit (højre). Begge strukturer blev bestemt gennem røntgenkrystallografi
Fluorescerende krystal mysterium løstSkematisk, der viser den ikke-lagdelte krystalstruktur af syntetisk coronen (venstre) og den lagdelte struktur af naturlig karpatit (højre). Begge strukturer blev bestemt gennem røntgenkrystallografi -
 Udvikling af elektrodemateriale, der forbedrer effektiviteten af saltholdighedsgradientenergiVed anvendelse af omvendt elektrodialysesystem (a) Effekttæthed (b) Strømspændingskurve (c) Modstand (d) Princip for strømgenerering (e og f) Elektrokemisk reaktion og elektronoverførselsprincip ved e
Udvikling af elektrodemateriale, der forbedrer effektiviteten af saltholdighedsgradientenergiVed anvendelse af omvendt elektrodialysesystem (a) Effekttæthed (b) Strømspændingskurve (c) Modstand (d) Princip for strømgenerering (e og f) Elektrokemisk reaktion og elektronoverførselsprincip ved e -
 Forskere udgiver køreplan for at udnytte datavidenskab og kunstig intelligens til elektronmikroskop…Kredit:CC0 Public Domain Siden de blev taget i brug i 1938, elektronmikroskoper har spillet en afgørende rolle i en lang række videnskabelige fremskridt, herunder opdagelsen af nye proteiner og
Forskere udgiver køreplan for at udnytte datavidenskab og kunstig intelligens til elektronmikroskop…Kredit:CC0 Public Domain Siden de blev taget i brug i 1938, elektronmikroskoper har spillet en afgørende rolle i en lang række videnskabelige fremskridt, herunder opdagelsen af nye proteiner og
- Hvad konverteres 76,2 kg til sten?
- Kunstig intelligens kan bruges til at afsløre hemmeligheder bag traditionel folkemusik, der går tu…
- Hvorfor to kræfter afbalancerer hinanden?
- Det ligger i generne:Forskning peger på, hvordan planter ved, hvornår de skal blomstre
- Ny grafenoxid-spraybelægning fremmer antiviral beskyttelse af ansigtsmasker
- Daimlers indtjening ramt af handelsspændinger, emissionsregler


