Hvorfor er vandig opløsning af kobbersulfat sur?
1. Kobber (II) ionhydrolyse:
* Når kobbersulfat opløses i vand, adskiller det sig til kobber (II) -ioner (Cu²⁺) og sulfationer (SO₄²⁻).
* Kobber (II) ioner er små og meget ladede, hvilket gør dem stærkt polariserende. Dette betyder, at de tiltrækker og trækker elektrondensitet fra iltatomerne i vandmolekyler.
* Denne interaktion svækker O-H-bindingerne i vandmolekyler, hvilket gør det lettere for hydrogenionerne (H⁺) at dissociere.
* Følgende ligevægtsreaktion opstår:
`` `
Cu²⁺ (aq) + 2h₂o (l) ⇌ [cu (h₂o) ₄] ²⁺ (aq) + h⁺ (aq)
`` `
2. Forøgelse i hydrogenionkoncentration:
* Hydrolyse -reaktionen producerer hydrogenioner (H⁺), hvilket øger koncentrationen af H⁺ i opløsningen.
* Da pH er et mål for hydrogenionkoncentrationen, resulterer en højere koncentration af H⁺ i en lavere pH -værdi.
3. Syre karakter:
* En lavere pH -værdi indikerer surhedsgrad. Derfor gør tilstedeværelsen af overskydende hydrogenioner (H⁺) i opløsningen på grund af hydrolyse af kobber (II) ion den vandige opløsning af kobbersulfatsyre.
Kortfattet: Aciditeten af en kobbersulfatopløsning opstår fra hydrolyse af kobber (II) -ionen, hvilket fører til frigivelse af hydrogenioner og en lavere pH.
 Varme artikler
Varme artikler
-
 Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik
Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik -
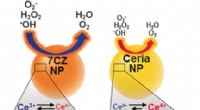 Ceria-zirconia nanopartikler som forbedrede multi-antioxidanter er effektive til behandling af sepsi…Kredit:Wiley Under sepsis, celler er oversvømmet med reaktive iltarter, der genereres i et afvigende respons fra immunsystemet på en lokal infektion. Hvis denne fatale inflammatoriske vej kunne fo
Ceria-zirconia nanopartikler som forbedrede multi-antioxidanter er effektive til behandling af sepsi…Kredit:Wiley Under sepsis, celler er oversvømmet med reaktive iltarter, der genereres i et afvigende respons fra immunsystemet på en lokal infektion. Hvis denne fatale inflammatoriske vej kunne fo -
 Det bedste fra begge verdener:Høj entropi møder lave dimensioner, åbner op for uendelige mulighed…Kredit:Tokyo Tech Opdagelsen af grafen, en 2D lagdelt form af kulstof, engang forårsagede et paradigmeskifte inden for videnskab og teknologi som ingen anden. Da dette vidundermateriale tiltrak
Det bedste fra begge verdener:Høj entropi møder lave dimensioner, åbner op for uendelige mulighed…Kredit:Tokyo Tech Opdagelsen af grafen, en 2D lagdelt form af kulstof, engang forårsagede et paradigmeskifte inden for videnskab og teknologi som ingen anden. Da dette vidundermateriale tiltrak -
 Laserfordampningsteknologi til at skabe nye solmaterialerKig inde på RIR-MAPLE-teknikken, der har evnen til at bygge ny solcellekrystalteknologi. Den hvide cirkel i midten af bordet er en frossen opløsning, der indeholder de molekylære byggesten til solce
Laserfordampningsteknologi til at skabe nye solmaterialerKig inde på RIR-MAPLE-teknikken, der har evnen til at bygge ny solcellekrystalteknologi. Den hvide cirkel i midten af bordet er en frossen opløsning, der indeholder de molekylære byggesten til solce
- Bruges polymerasekædereaktion til at amplificere DNA fra en fossil føtalcelle eller virus?
- Hvordan påvirker densitet brændstofeffektivitet?
- Hvilken del af metallisk bindingsteori hjælper mest med at forklare, hvorfor metaller er i stand ti…
- Trykket er slukket, og høj temperatur superledningsevne forbliver
- Det naturlige comeback af tropiske regnskove i savanneregionen
- Sådan fungerer F/A-22 Raptors


