Hvorfor smeltet kobberchlorid adfærd elektricitet?
Her er hvorfor:
* ioniske forbindelser: Kobberchlorid er en ionisk forbindelse, hvilket betyder, at det dannes af den elektrostatiske tiltrækning mellem positivt ladede kobberioner (Cu²⁺) og negativt ladede chloridioner (CL⁻).
* solid tilstand: I sin solide tilstand er ionerne tæt pakket i en krystalgitter, hvilket gør det til en dårlig leder. Ionerne er fastgjort i position og kan ikke bevæge sig frit.
* smeltet tilstand: Når kobberchlorid smeltes, overvindes de stærke elektrostatiske kræfter, der holder ionerne sammen. Dette gør det muligt for ionerne at bevæge sig frit inden for væsken.
* Elektrisk strøm: Når et elektrisk potentiale påføres på tværs af det smeltede kobberchlorid, bevæger de positivt ladede kobberioner mod den negative elektrode (katode), og de negativt ladede chloridioner bevæger sig mod den positive elektrode (anode). Denne bevægelse af ioner udgør en elektrisk strøm.
Derfor giver tilstedeværelsen af frie, mobile ioner i smeltet kobberchlorid det mulighed for at udføre elektricitet.
Sidste artikelHvad er oxidformel for RB?
Næste artikelHvad er den strukturelle formel for H2?
 Varme artikler
Varme artikler
-
 Rød eller gul? En simpel papirtest afslører falske eller substandard antibiotikaEn enkel, papirbaseret test kan hurtigt identificere et forfalsket eller substandard antibiotikum. Kredit:John Eisele/Colorado State University Antibiotika – medicin, der behandler bakterielle inf
Rød eller gul? En simpel papirtest afslører falske eller substandard antibiotikaEn enkel, papirbaseret test kan hurtigt identificere et forfalsket eller substandard antibiotikum. Kredit:John Eisele/Colorado State University Antibiotika – medicin, der behandler bakterielle inf -
 Forskningsgennembrud kan transformere ren energiteknologiKredit:Pixabay/CC0 Public Domain Efter nogle skøn, mængden af solenergi, der når jordens overflade på et år, er større end summen af al den energi, vi nogensinde kunne producere ved hjælp af i
Forskningsgennembrud kan transformere ren energiteknologiKredit:Pixabay/CC0 Public Domain Efter nogle skøn, mængden af solenergi, der når jordens overflade på et år, er større end summen af al den energi, vi nogensinde kunne producere ved hjælp af i -
 Skies of blue:Genanvendelse af kulstofemissioner til nyttige kemikalier og reduktion af den globale …Tilførsel af proton øger CO-elektrosyntesen til produktion af acetat og flygtige fedtsyrer. Kredit:Pusan National University Hurtig global urbanisering har dramatisk ændret vores planets ansigt,
Skies of blue:Genanvendelse af kulstofemissioner til nyttige kemikalier og reduktion af den globale …Tilførsel af proton øger CO-elektrosyntesen til produktion af acetat og flygtige fedtsyrer. Kredit:Pusan National University Hurtig global urbanisering har dramatisk ændret vores planets ansigt, -
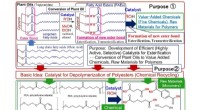 En højtydende katalysator, der opløser polyester og realiserer kemisk genbrugKatalysatorudvikling ikke kun til effektiv omdannelse af planteolier (FAEer) til værditilvækstkemikalier (finkemikalier) og råmaterialer til polymerer, men også til effektiv depolymerisering (kemisk g
En højtydende katalysator, der opløser polyester og realiserer kemisk genbrugKatalysatorudvikling ikke kun til effektiv omdannelse af planteolier (FAEer) til værditilvækstkemikalier (finkemikalier) og råmaterialer til polymerer, men også til effektiv depolymerisering (kemisk g
- Palmeolie er overalt. Her er hvorfor det betyder noget.
- Hvad sker der med overfladen, når det vandrette tryk påføres klipper?
- Hvordan nitrogen overføres af en katalysator
- Hvordan er ure relateret til matematik?
- Hvorfor en canadisk nikkel fra 1982 holder sig til magneten?
- Hvorfor ser du kun de tørre landområder med tektoniske plader på et typisk verdenskort?


