24 g ch4 reagerer med 96 g o2?
1. Den kemiske ligning
Reaktionen af methan (CH4) og ilt (O2) er en forbrændingsreaktion, der producerer kuldioxid (CO2) og vand (H2O):
CH4 + 2O2 → CO2 + 2H2O
2. Støkiometri
Ligningen fortæller os følgende:
* 1 mol CH4 reagerer med 2 mol O2
* 1 mol CH4 producerer 1 mol CO2
* 1 mol CH4 producerer 2 mol H2O
3. Molære masser
* CH4:12,01 g/mol (C) + 4 * 1,01 g/mol (H) =16,05 g/mol
* O2:2 * 16,00 g/mol (O) =32,00 g/mol
4. Beregninger
* mol af CH4: 24 g / 16,05 g / mol =1,5 mol
* mol O2: 96 g / 32,00 g / mol =3 mol
5. Begrænsende reaktant
* fra ligningen: 1 mol CH4 har brug for 2 mol O2.
* Vi har: 1,5 mol CH4 og 3 mol O2.
* Dette betyder: Vi har nok O2 til at reagere med alle CH4. CH4 er den begrænsende reaktant.
6. Produktberegninger
* CO2 produceret: 1,5 mol CH4 * (1 mol CO2 / 1 mol CH4) =1,5 mol CO2
* Mass af CO2: 1,5 mol * 44,01 g/mol =66,02 g
* h2o produceret: 1,5 mol CH4 * (2 mol H2O / 1 mol CH4) =3 mol H2O
* masse af H2O: 3 mol * 18,02 g/mol =54,06 g
Konklusion
Når 24 g CH4 reagerer med 96 g O2:
* CH4 er den begrænsende reaktant.
* 66,02 g CO2 og 54,06 g H2O produceres.
 Varme artikler
Varme artikler
-
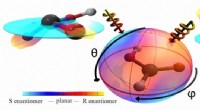 Duplikat eller spejl? Laserlys bestemmer chiralitet af molekylerMyresyremodellen er i centrum. Farvekoden for den omgivende kugle viser myresyrens direkte chiralitet for hver retning, hvorfra laseren kommer. Kredit:Goethe-Universität Frankfurt am Main I medici
Duplikat eller spejl? Laserlys bestemmer chiralitet af molekylerMyresyremodellen er i centrum. Farvekoden for den omgivende kugle viser myresyrens direkte chiralitet for hver retning, hvorfra laseren kommer. Kredit:Goethe-Universität Frankfurt am Main I medici -
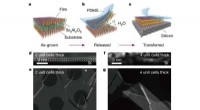 Forskere finder en måde at producere fritstående film af perovskitoxiderVækst og overførsel af ultratynde fritstående SrTiO3 -film. en, Skematisk af en film med et SAO -bufferlag. b, Det opofrende SAO -lag opløses i vand for at frigive de øverste oxidfilm med mekanisk und
Forskere finder en måde at producere fritstående film af perovskitoxiderVækst og overførsel af ultratynde fritstående SrTiO3 -film. en, Skematisk af en film med et SAO -bufferlag. b, Det opofrende SAO -lag opløses i vand for at frigive de øverste oxidfilm med mekanisk und -
 Opsamling af rent vand fra luften, inspireret af ørkenlivetKredit:CC0 Public Domain Mennesker kan klare sig i de mest basale krisecentre, kan ridse et måltid sammen af de mest ydmyge ingredienser. Men vi kan ikke overleve uden rent vand. Og på steder, h
Opsamling af rent vand fra luften, inspireret af ørkenlivetKredit:CC0 Public Domain Mennesker kan klare sig i de mest basale krisecentre, kan ridse et måltid sammen af de mest ydmyge ingredienser. Men vi kan ikke overleve uden rent vand. Og på steder, h -
 Nyt materiale efterligner styrke, perlemors sejhedDen iriserende perlemor inde i en Nautilus-skal. Billede:Wikipedia. Om sommeren, mange mennesker nyder gåture langs stranden på udkig efter muslingeskaller. Blandt de mest værdsatte er dem, der in
Nyt materiale efterligner styrke, perlemors sejhedDen iriserende perlemor inde i en Nautilus-skal. Billede:Wikipedia. Om sommeren, mange mennesker nyder gåture langs stranden på udkig efter muslingeskaller. Blandt de mest værdsatte er dem, der in
- Søger ud over grafen efter nye vidundermaterialer
- Hvad er massefylden af en genstand med en masse på 50g og volumen 5 cm3?
- Hvorfor ville du ikke forvente, at alle molekylerne luft i dit værelse har samme gennemsnitlige has…
- Hvad observerede du skete, da en P -bølge rejste fra fast til væske?
- Hvad er klippelagene sammen?
- Den libyske ørkens gule glas:Hvordan vi opdagede oprindelsen af disse sjældne og mystiske skår


