Brug af spektroskopisk notation Hvad er den komplette elektronkonfiguration til kaliumatom?
1S² 2S² 2P⁶ 3S² 3P⁶ 4S¹
Forklaring:
* 1S²: Det første energiniveau (n =1) har et (er), der kan indeholde maksimalt 2 elektroner.
* 2s²: Det andet energiniveau (n =2) har et S -sublevel, der indeholder 2 elektroner.
* 2p⁶: Det andet energiniveau (n =2) har også et P -underniveau, der kan holde op til 6 elektroner.
* 3S²: Det tredje energiniveau (n =3) har et S -sublevel, der indeholder 2 elektroner.
* 3p⁶: Det tredje energiniveau (n =3) har også et P -underniveau, der indeholder 6 elektroner.
* 4S¹: Det fjerde energiniveau (n =4) har et S -underniveau, der indeholder 1 elektron. Dette er kaliums valenselektron.
Vigtig note: 4S -orbitalen udfylder før 3D -orbitalen, fordi 4S -orbitalen har et lavere energiniveau. Dette er grunden til, at kalium har et enkelt elektron i sin yderste skal.
Sidste artikelHvilke af disse metaller oxideres af ionerne aluminium?
Næste artikelHvordan oxideres en sammensat?
 Varme artikler
Varme artikler
-
 Nyt materiale udvinder kobber fra giftigt spildevandFra venstre:Skematisk diagram af et ZIOS-netværk; og et SEM-billede (scanning elektronmikroskopi) af en ZIOS-kobberprøve på en siliciumwafer. Kredit:Berkeley Lab Vi er afhængige af vand for at slu
Nyt materiale udvinder kobber fra giftigt spildevandFra venstre:Skematisk diagram af et ZIOS-netværk; og et SEM-billede (scanning elektronmikroskopi) af en ZIOS-kobberprøve på en siliciumwafer. Kredit:Berkeley Lab Vi er afhængige af vand for at slu -
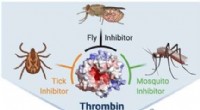 Potente trivalente hæmmere af thrombin fra antikoaguleringspeptider i insektspytKredit:Angewandte Chemie International Edition Trombose, tilstopning af blodkar, er en væsentlig årsag til hjerteanfald og emboli. Forskere har nu konstrueret de første hæmmere af thrombin, en pro
Potente trivalente hæmmere af thrombin fra antikoaguleringspeptider i insektspytKredit:Angewandte Chemie International Edition Trombose, tilstopning af blodkar, er en væsentlig årsag til hjerteanfald og emboli. Forskere har nu konstrueret de første hæmmere af thrombin, en pro -
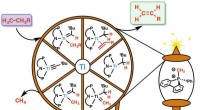 Billig, energieffektiv og ren reaktion til fremstilling af kemisk råmaterialeRepræsentation af kulstof-brint-nedbrydningsreaktionen med en spindel. Olefiner, det vil sige molekyler med en dobbeltbinding mellem kulstofatomer (C=C, grøn boks) genereres fra et ureaktivt molekyle
Billig, energieffektiv og ren reaktion til fremstilling af kemisk råmaterialeRepræsentation af kulstof-brint-nedbrydningsreaktionen med en spindel. Olefiner, det vil sige molekyler med en dobbeltbinding mellem kulstofatomer (C=C, grøn boks) genereres fra et ureaktivt molekyle -
 Hårfarve er giftigt – kan naturlige alternativer fås til at virke?Henna hårfarve er naturligt, men begrænset. Kredit:fotolotos/Shutterstock Ved du virkelig, hvad du sætter på dit hår? Mange hårfarver, du kan købe i butikkerne eller frisøren, indeholder giftige k
Hårfarve er giftigt – kan naturlige alternativer fås til at virke?Henna hårfarve er naturligt, men begrænset. Kredit:fotolotos/Shutterstock Ved du virkelig, hvad du sætter på dit hår? Mange hårfarver, du kan købe i butikkerne eller frisøren, indeholder giftige k
- 3D-trykte vatpinde for at hjælpe med at udfylde hullet i COVID-19 testsæt
- Hvilken type elektromagnetisk energi kunne bruges til at desinficere vand?
- Er gæring en form for respiration eller fotosyntese?
- Kan du give mig et eksempler på elektrisk energi?
- Hvad hedder væsken i alveoler?
- Designer-defekt medieret fastspænding af ferroelektriske domænevægge for mere stabil nanoelektron…


