Hvad er pH af regnvand i ligevægt med atmosfære?
Her er hvorfor:
* kuldioxid (CO2) i atmosfæren: Regnvand er naturligt surt på grund af tilstedeværelsen af opløst kuldioxid (CO2) fra atmosfæren.
* dannelse af kulsyre: Når CO2 opløses i vand, danner det kulsyre (H2CO3), som derefter dissocieres til hydrogenioner (H+) og bicarbonationer (HCO3-).
* ligevægt: PH -værdien af regnvand når et ligevægtspunkt, hvor hastigheden for CO2 -opløsning i vand svarer til hastigheden for CO2, der undgår fra vandet.
* pH 5,6: Dette ligevægtspunkt resulterer i en pH på ca. 5,6, hvilket betragtes som let surt.
Vigtig note: Den faktiske pH i regnvand kan variere afhængigt af faktorer som:
* Forurening: Industrielle emissioner, såsom svovldioxid (SO2) og nitrogenoxider (NOX), kan øge surt vandets surhed.
* placering: Regnvand i områder med høje forureningsniveauer kan have en lavere pH end regnvand i uberørte miljøer.
* Andre atmosfæriske gasser: Andre gasser som ozon og ammoniak kan også påvirke pH i regnvand.
Mens en pH på 5,6 betragtes som normal for regnvand, indikerer enhver pH -værdi end dette surt regn , som kan have negative indvirkninger på miljøet og menneskers sundhed.
Sidste artikelHvilken gas produceres, når et metal reagerer med en syre?
Næste artikelKomplet redoxreaktion under sur tilstand MnO4 H2O2?
 Varme artikler
Varme artikler
-
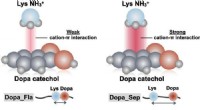 Hemmeligheden bag muslingers klæbrighed under vandetKredit:Pohang University of Science &Technology (POSTECH) Muslinger overlever ved at holde sig til sten i de voldsomme bølger eller tidevand under vandet. Materialer, der efterligner denne underva
Hemmeligheden bag muslingers klæbrighed under vandetKredit:Pohang University of Science &Technology (POSTECH) Muslinger overlever ved at holde sig til sten i de voldsomme bølger eller tidevand under vandet. Materialer, der efterligner denne underva -
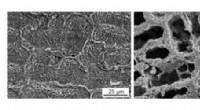 Forskere styrker det svageste led i fremstilling af stærke materialerOverfladeudseende af det udviklede stål indeholdende kobber (venstre) og kobberfrit modstykke (højre). Kredit:Kenta Yamanaka et al, Tohoku Universitet Industriel og bilmaskiner, såsom bildele i mo
Forskere styrker det svageste led i fremstilling af stærke materialerOverfladeudseende af det udviklede stål indeholdende kobber (venstre) og kobberfrit modstykke (højre). Kredit:Kenta Yamanaka et al, Tohoku Universitet Industriel og bilmaskiner, såsom bildele i mo -
 Indlejret dråbeprint-teknologi udskriver og behandler kontrollerbart dråber, der er suspenderet på…Den nye indlejrede metode til udskrivning af dråber suspenderer 3D-arrays af dråber i en unikt isoleret tilstand, der giver mulighed for præcis behandling og eksperimentering Kredit:Singapore-MIT Alli
Indlejret dråbeprint-teknologi udskriver og behandler kontrollerbart dråber, der er suspenderet på…Den nye indlejrede metode til udskrivning af dråber suspenderer 3D-arrays af dråber i en unikt isoleret tilstand, der giver mulighed for præcis behandling og eksperimentering Kredit:Singapore-MIT Alli -
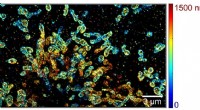 Nyt værktøj kan hjælpe molekylærbiologer med at forstå komplekse processer i cellerRekonstrueret 3D sSMLM med pseudofarver svarende til z-aksepositionerne af individuelle molekyler. Kredit:Northwestern University Northwestern Engineering-forskere har udviklet en ny platform, der
Nyt værktøj kan hjælpe molekylærbiologer med at forstå komplekse processer i cellerRekonstrueret 3D sSMLM med pseudofarver svarende til z-aksepositionerne af individuelle molekyler. Kredit:Northwestern University Northwestern Engineering-forskere har udviklet en ny platform, der
- Kokosolieforbindelser frastøder insekter bedre end DEET
- Hvordan beregner du den krafte, der er nødvendig for at trække en masse på 20GK ved ensartet lang…
- Hvad er regioner med høje temperaturer og lysstyrke, som solen kaldte?
- Interferometer
- Hvad er en usædvanligt lys stjerne?
- Hvorfor kan en nymåne ses på nattehimlen?


